Леккия №17
РАСТВОРЫ
Общая характеристика растворов.
Способы выражения концентрации растворов.
Термодинамика и механизм процесса растворения.
Растворимость.
Вода как растворитель. Значение растворов в жизнедеятельности организмов
1. Общая характеристика растворов.
Растворы – это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0,1 – 0,5 нм).
Образование растворов, в отличие от механических смесей, сопровождается изменением энтальпии, энтропии и объема системы.
По агрегатному состоянию различают газовые, жидкие и твердые растворы. Но обычно термин растворы относится к жидким системам.
2. Способы выражения концентрации растворов.
Относительное содержание компонентов в растворе определяется его концентрацией.
Молярная концентрация – это количество вещества, содержащееся в одном литре раствора (моль/л):
Э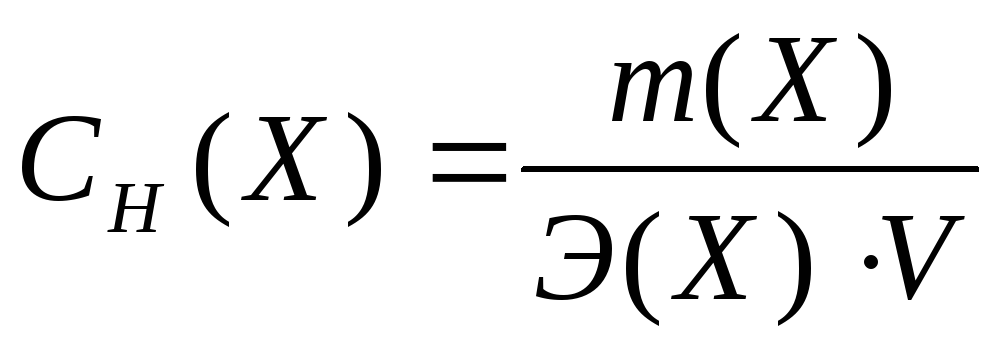 квивалентная
концентрация
– это число молей
эквивалентов вещества, содержащихся в
одном литре раствора (моль/л):
квивалентная
концентрация
– это число молей
эквивалентов вещества, содержащихся в
одном литре раствора (моль/л):
Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону.
Масса одного моля эквивалентов называется молярной массой эквивалента вещества (Э). В разных реакциях одно и то же вещество может иметь разные эквиваленты.
Моляльная концентрация – это количество вещества, содержащееся в одном килограмме растворителя (моль/кг):
М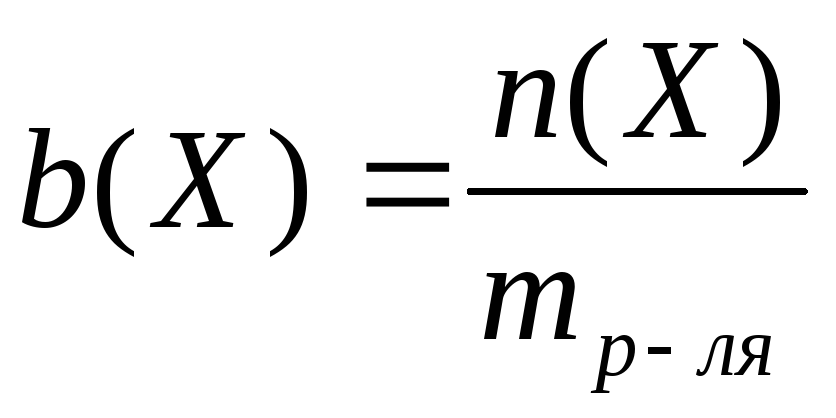 ассовая
доля
равна отношению массы растворенного
вещества к массе раствора:
ассовая
доля
равна отношению массы растворенного
вещества к массе раствора:
М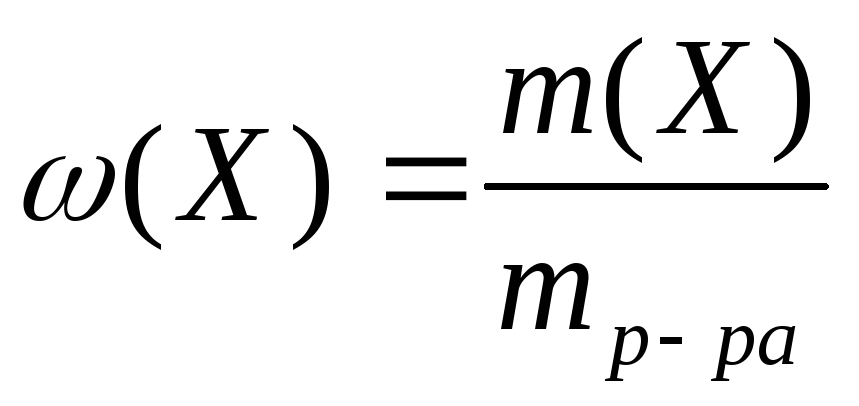 олярная
доля
равна отношению количества
растворенного вещества в общему
количеству веществ в растворе:
олярная
доля
равна отношению количества
растворенного вещества в общему
количеству веществ в растворе:
К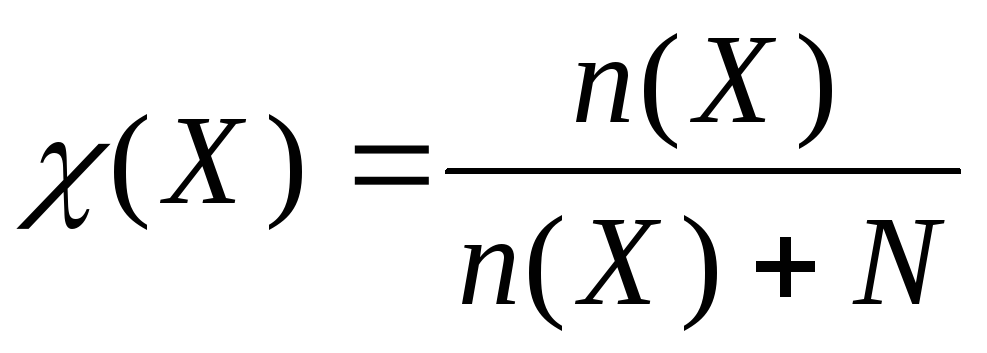 ак
правило, вещество обладает определенной
растворимостью в данном растворителе.
Подрастворимостью
понимают
концентрацию вещества в насыщенном
растворе.
ак
правило, вещество обладает определенной
растворимостью в данном растворителе.
Подрастворимостью
понимают
концентрацию вещества в насыщенном
растворе.
3. Термодинамика и механизм процесса растворения
Растворение – сложный физико-химический процесс, включающий три основные стадии, каждая из которых характеризуется изменениями термодинамических функций Н иS:
разрушение химических и межмолекулярных связей в растворяемом веществе (например, разрушение кристаллической решетки): Н 1 >0,S 1 >0
химическое взаимодействие частиц растворенного вещества с растворителем (сольватация): Н 2 <0,S 2 <0
равномерное распределение частиц растворенного вещества в среде растворителя путем диффузии: Н 3 >0,S 3 >0
Согласно 2-му закону термодинамики условием самопроизвольности процесса растворения является убыль энергии Гиббса:
G=H-TS< 0,
которая складывается из энтальпийного Н и энтропийногоTSфакторов.
Растворение газов в жидкостях приводит к упорядочению системы и, следовательно, сопровождается уменьшением энтропии: S р-ния <0. Движущей силой процесса растворения в этом случае является энтальпийный фактор и растворение большинства газов является процессом экзотермическим:Н р-ния <0. Таким образом, самопроизвольное растворение газов возможно при низких температурах (|Н| > |TS|)
Растворение жидких и твердых веществ в жидкостях приводит к увеличению беспорядка в системе и увеличению энтропии: S р-ния >0. Суммарный тепловой эффект процесса растворения определяется в основном слагаемымиН 1 иН 2 и в зависимости от их соотношения может и быть и положительным (NaCl), и отрицательным (NaOH). Растворение большинства кристаллических веществ – процесс эндотермическийН р-ния >0, так как энергия, затрачиваемая на разрушение кристаллической решетки не компенсируется энергией, выделяемой за счет сольватации. Таким образом, самопроизвольному растворению большинства твердых веществ способствуют высокие тепмературы (|Н| < |TS|).
Растворы, образование которых не сопровождается изменениями объема системы и тепловыми эффектами (V=0,Н=0), называютидеальными . Движущей силой образования идеального раствора является увеличение энтропии системы. Идеальный раствор – понятие абстрактное. Реальные системы могут лишь приближаться к идеальным. Наиболее близки к модели идеального раствора системы, в которых компоненты близки по свойствам и практически не взаимодействуют друг с другом (например, раствор толуола в бензоле). Приближаются по свойствам к идеальным бесконечно разбавленные растворы, в которых взаимодействиях сводятся к минимуму за счет низкой концентрации растворенного вещества.
4. Растворимость
Под растворимостью понимают концентрацию растворенного вещества в насыщенном растворе.
Растворимость выражают в тех же единицах, что и концентрацию. Часто используют коэффициент растворимости s, равный массе растворенного вещества (г) в насыщенном растворе, содержащем 100 г растворителя.
Насыщенным называют раствор, который находится в равновесии с избытком растворяемого вещества (G р-ния =0). Насыщенный раствор имеет максимально возможную в данных условиях концентрацию.
Растворимость зависит:
от природы растворенного вещества и растворителя;
от температуры;
от давления;
от присутствия третьих компонентов.
Влияние природы компонентов на растворимость определяется принципом:подобное растворяется в подобном . Полярные растворители, например, вода, хорошо растворяют вещества с ионной связью (неорганические соли, кислоты и основания). Хорошей растворимостью в воде обладают полярные органические соединения, образующие с молекулами растворителя водородные связи (спирты, карбоновые кислоты, амины). Неполярные растворители, например, углеводороды, растворяют неполярные и малополярные соединения (жиры).
Влияние температуры на растворимость зависит от теплового эффекта растворения и определяется принципом Ле Шателье. Повышению растворимости газов способствует понижение температуры, так как растворение газов – процесс экзотермический. Растворимость большинства твердых веществ и жидкостей - процесс эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении происходит значительное изменение объема системы, что наблюдается при растворении газов в жидкостях. Растворимость газов растет с увеличением давления, так как сопровождается уменьшением объема системы.
Закон Генри:
Количество газа, растворенного в определенном объеме жидкости при постоянной температуре прямо пропорционально давлению газа.
c (X ) = K г p (X )
где c(X) – молярная концентрация газа,моль/л
K г - константа Генри, моль/лПа
p(X) – давление газа над раствором, Па
Влияние присутствия третьих компонентов.
Растворимость газов в жидкостях значительно снижается в присутствии электролитов (солей) Этот процесс называют высаливанием .
Закон Сеченова:
Растворимость газов в жидкостях в присутствии электролитов понижается.
С(X) = С 0 (X)
где С(X) – растворимость газа в присутствии электролита
С 0 (X) – растворимость газа в чистом растворителе
К С - константа Сеченова
С э - концентрация электролита
Биологическое значение законов Генри и Сеченова.
Изменение растворимости газов в крови при изменении давления может привести к тяжелым заболеванием. Кесонная болезнь у водолазов – проявление закона Генри. В соответствии с законом Сеченова растворимость кислорода и углекислого газа в крови зависит от концентрации электролитов, а также белков, липидов и других веществ.
5. Вода как растворитель. Значение растворов в жизнедеятельности организмов
Самым распространенным растворителем на нашей планете является вода. У животных и растительных организмов содержание воды составляет обычно более 50%, а в ряде случаев достигает 90-95%.
Вода хорошо растворяет многие ионные и полярные соединения. Такое свойство воды связано с ее высокой диэлектрической проницаемостью (= 78,5). В результате многие ионные соединения диссоциируют и отличаются высокой растворимостью в воде. Другой класс веществ, хорошо растворимых в воде, составляют полярные органические соединения (спирты, альдегиды, кетоны). Их растворимость обусловлена образованием водородных связей с молекулами воды.
Важны и другие аномальные свойства воды: высокое поверхностное натяжение, низкая вязкость, высокие температуры плавления и кипения, более высокая плотность в жидком состоянии, чем в твердом.
Вследствие высокой полярности вода вызывает гидролиз веществ (эфиров, амидов и др.). Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Биохимические процессы в живых организмах протекает в водных растворах.
В жидких средах организма поддерживается постоянство рН, концентрации солей и органических веществ, постоянство осмотического давления. Такое постоянство называется гомеостазом. Приведенные примеры показывают, что учение о растворах представляет особый интерес для медиков.
Типы растворов, термодинамика растворения
Растворы имеют важное практическое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи связаны с переводом питательных веществ в раствор. Растворами являются все физиологические жидкости, например, такие как кровь, лимфа. В основе многих производств лежат химические процессы, связанные с использование или производством растворов. Например, молочные продукты, творог, сметана, кефир, соки, напитки.
Молекулярным или истинным раствором называется гомогенная система, состоящая из двух и более компонентов. От молекулярных растворов следует отличать коллоидные растворы: суспензии, эмульсии, аэрозоли. Коллоидные от молекулярных растворов отличаются тем, что они представляют собой многокомпонентные гетерогенные системы. Примерами молекулярных растворов являются водный раствор хлористого натрия, воздух, сплав серебра с золотом. Уже из приведенных примеров видно, что типы растворов могут быть разные.
Растворы могут находиться в трех агрегатных состояниях: газообразном, жидком, твёрдом. Поэтому различают жидкие растворы, газовые растворы, твердые растворы. Раствор состоит из растворенного вещества и растворителя. Растворителем считают тот компонент, который находится в том же агрегатном состоянии, что и сам раствор. Если все компоненты находятся в одинаковом состоянии, то растворителем считается тот компонент, который находится в большем количестве. Очень большое распространение имеют водные растворы, в которых растворителем является вода, например: водный раствор соляной кислоты, водный раствор спирта.
Жидкие растворы обладают элементами кристаллической структуры. В них имеется ближний порядок, то есть каждая частица раствора окружена определенным числом других частиц, находящихся от данной на строго определенном расстоянии. Для более удаленных частиц этот порядок нарушается. Растворы, как и все жидкости, не обладают дальним порядком, который наблюдается в кристаллах.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. Однородность раствора делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах растворах можно обнаружить многие свойства его отдельных компонентов, что не наблюдается у химических соединений. Непостоянство состава раствора приближает их к механическим смесям, но от последних они резко отличаются своей однородностью.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. В таких растворах при заданной температуре не может раствориться большее количество растворенного вещества. Насыщенный раствор находится в динамическом равновесии с нерастворимой частью растворяемого вещества. Например, если поместить в воду избыточное количество хлорида натрия, образуется насыщенный раствор, в котором твердый хлорид натрия находится в динамическом равновесии с растворенным хлоридом натрия
NaCl (тв.) NaCl(водн.).
Большинство кристаллов растворяется в жидкостях с поглощением теплоты, однако при растворении таких веществ, как гидроксид натрия NaOH, карбонат калия K 2 CO 3 , сульфат меди CuSO 4 происходит заметное увеличение температуры раствора. Выделяется теплота, но в меньших количествах, при растворении некоторых жидкостей и всех газов.
Количество теплоты, которое поглощается или выделяется при растворении одного моль вещества, называется теплотой растворения этого вещества. При растворении кристаллов происходит их разрушение, что требует затрат энергии, поэтому растворение должно сопровождаться поглощением теплоты. Если наблюдается обратный эффект, то это говорит о том, что помимо растворения происходит взаимодействие между растворителем и растворенным веществом, в результате которого выделяется энергии больше, чем её расходуется на разрушение кристаллической решетки.
При растворении кристаллического вещества воде происходит сближение его частиц с дипольными молекулами воды, потенциальная энергия уменьшается, и теплота выделяется, то есть растворение сопровождается сжатием, которое рассматривается как уплотнение молекул растворителя вокруг каждой частицы растворяемого вещества. При этом частицы химически связываются с молекулами растворителя, образуя соединение, которое называется сольватом.
Совокупность молекул растворителя, окружающих частицу растворенного вещества, называется сольватной оболочкой. Взаимодействие молекул растворителя с частицами растворенного вещества называется сольватацией.
Если растворителем является вода, то сольватация называется гидратацией, а сольватную оболочку называют гидратной. Соединения молекул растворенного вещества с молекулами воды называются гидратами.
Гидраты, образующиеся в результате донорно-акцепорного взаимодействия, представляют собой частный случай комплексных соединений. Предположение о существовании в водных растворах гидратов было высказано и обосновано в 80-х годах 19 века Д.И. Менделеевым. Он считал, что растворение – это не только физический процесс, но и химический, что вещества, растворяющиеся в воде, образуют с ней соединения.
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты так прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Растворимость.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества служит его содержание в насыщенном растворе при определенных условиях. Численно растворимость выражается теми же способами, что и состав. Например, процентное отношение массы растворенного вещества к массе насыщенного раствора, или количество растворенного вещества, содержащегося в 1 литре насыщенного раствора. Иногда для характеристики растворимости используют коэффициент растворимости. Коэффициентом растворимости называется число единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя.
Растворимость различных веществ в оде изменяется в широких пределах. Если в
100 г воды растворяется более 10 г вещества, то такое вещество считается хорошо растворимым. Если растворяется менее 1 г вещества, то его считают малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод). Это подтверждает эмпирическое правило «подобное растворяется в подобном».
Растворимость зависит от температуры. Для некоторых веществ такая зависимость имеет слабый характер. Например, растворимость нитратов калия, свинца, серебра (KNO 3 , Pb(NO 3) 2 , AgNO 3) в воде резко увеличивается с повышением температуры. Растворимость хлорида натрия (NaCl) в воде лишь незначительно изменяется по мере повышения температуры.
При растворении твердых тел в воде объём системы обычно изменяется незначительно. Поэтому растворимость твердых тел в воде практически не зависит от давления.
Жидкости могут растворяться друг в друге. Некоторые из них, например, спирт – вода, неограниченно растворимы, то есть смешиваются друг с другом в любых пропорциях. Есть жидкости, которые взаимно растворимы лишь до определенного предела, их называют частично смешивающимися. Если взболтать диэтиловый эфир с водой, то образуются два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний – насыщенный раствор эфира в воде. Для таких систем с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях. Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Так, при температуре ниже 66,4 0 С фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле. Для системы вода – фенол температура 66,4 0 С является критической температурой растворения, так как начиная с этой температуры и выше, обе жидкости неограниченно растворимы друг в друге.
Ограниченно растворимыми жидкостями являются следующие системы: нитробензол – н-гексан, триэтиламин – вода, никотин – вода.
Взаимное растворение жидкостей обычно не сопровождается значительными изменениями объёма, поэтому мало зависит от давления. Лишь при очень высоких давлениях порядка тысяч атмосфер взаимная растворимость жидкостей существенно возрастает.
Встречаются жидкости, которые полностью нерастворимы друг в друге, их называют несмешивающимися жидкостями. Если обе жидкости нерастворимы одна в другой, то при смешивании в любых пропорциях образуется два отдельных слоя. Примерами таких жидкостей являются следующие: ртуть – вода, дисульфид углерода – вода, хлорбензол – вода, фениламин – вода.
Если в систему, состоящую из двух несмешивающихся жидкостей, ввести третье вещство, способное растворяться в каждой из этих жидкостей, то растворенное вещество будет расперделяться между обеими жидкостями, пропорционально своей растворимости в каждой их них. Для таких систем выполняется закон распределения согласно которому:
вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества
К(В) = с 1В /с 2В,
где с 1В и с 2В – концентрации растворенного вещества в первом и втором растворителях, К(В) – константа распределения вещества В между двумя несмешивающимися жидкостями.
Например, константа распределения йода между хлороформом и водой равна 130. Если к воде, содержащей растворенный йод, добавить несмешивающийся с нею хлороформ, взболтать эту систему и дать её отстояться, то после установления равновесия концентрация йода в хлороформе будет в 130 раз выше, чем в воде, независимо от общего количества растворенного йода. Таким образом, с помощью хлороформа можно извлечь из воды преобладающую часть растворенного в ней йода. Такой способ извлечения растворенного вещества из раствора с помощью второго растворителя, несмешивающегося с первым, называется экстракцией.
Закон распределения имеет ряд важных применений. Наиболее известные – это жидкофазная хроматография и экстракция.
Две несмешивающиеся жидкости иногда используют как селективные растворители для компонентов какой-либо смеси. Такую смесь сначала встряхивают с двумя несмешивающимися жидкостями, а затем отделяют одну жидкость от другой. Каждый слой по несколько раз подвергают экстракции с другим растворителем.
Например, данный способ используется для выделения солей урана из продуктов ядерного деления. Уранильную соль UO 2 (NO 3) 2 отделяют от NaCl с помощью бутанола и воды по методике противоточной экстракции. Известно, что уранильная соль лучше растворима в бутаноле, а хлористый натрий в воде. Один из растворителей пропускают над твердой смесью, находящейся в колонке. Затем над смесью в противоположном направлении пропускается другой растворитель. Для получения полного разделения этот процесс повторяют несколько раз.
Характеристика растворов. Процесс растворения. Состав и свойства растворов;
Способы количественного выражения состава растворов
Характеристика растворов. Процесс растворения. Состав и свойства растворов
Раствором называется твёрдая или жидкая гомогенная физико-химическая система, состоящая из двух или более компонентов, количества которых могут изменяться в широких пределах . Гомогенной называется система, состоящая из одной фазы (например, только жидкой, только твёрдой, или только газообразной фазы). Фаза – это часть системы, отделённая от других частей этой же системы поверхностью раздела, при переходе через которую свойства изменяются скачком . Гетерогенная система состоит из нескольких фаз, отделённых друг от друга поверхностью раздела.
Примеры гомогенных систем: любая газовая смесь, раствор сахара в воде. Примеры гетерогенных систем: вода со льдом, насыщенный раствор с осадком (жидкая фаза и твёрдая фаза), угольная пыль в атмосфере (твёрдая фаза и газовая фаза), смесь песка и мела (твёрдая фаза песка и твёрдая фаза мела), смесь подсолнечного масла и воды (жидкая фаза масла и жидкая фаза воды).
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Растворителем обычно считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ также указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов сближает их с механическими смесями, но от смесей они отличаются своей гомогенностью.
Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Наиболее важный вид растворов – жидкие растворы, которые рассматриваются далее более подробно.
Растворение кристалла твёрдого вещества в жидкости протекает следующим образом. Когда кристалл вносят в жидкость, в которой он может растворяться, от его поверхности отрываются отдельные молекулы или ионы, которые вследствие диффузии равномерно распределяются по всему объёму растворителя. Отделение молекул или ионов от твёрдого тела вызвано, с одной стороны, их собственным колебательным движением, а с другой – притяжением к молекулам растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы или ионы, сталкиваясь с поверхностью ещё нерастворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. Выделение молекул или ионов из раствора будет происходить тем быстрее, чем больше их концентрация в растворе. Так как концентрация по мере растворения увеличивается, то наступит момент химического равновесия, когда скорость растворения равна скорости кристаллизации.
Растворы имеют большое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Растворы – многокомпонентные гомогенные системы, в которых одно или несколько веществ распределены в виде молекул, атомов или ионов в среде другого вещества – растворителя.
Раствор может иметь любое агрегатное состояние – твердое, жидкое или газообразное. Всякий раствор состоит из растворенных веществ и растворителя. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, раствор соли в воде: соль – растворенное вещество, вода – растворитель). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
По структуре растворы занимают промежуточное положение между механическими смесями и химическими соединениями. С механическими смесями их роднит переменность состава, а с химическими соединениями – однородность состава по всей фазе и наличие теплового эффекта при образовании. В соответствии с этим первое время существовали две противоборствующие теории: "физическая" и "химическая", каждая из которых отстаивала свои взгляды на строение растворов.
Современные представления о строении растворов основываются на сольватной теории, выдвинутой Менделеевым и развитой его последователями. Согласно этой теории, в системе при растворении одновременно происходит два процесса: диффузия растворяемого вещества в объеме растворителя (физический процесс) и образования из молекул растворителя и растворяемого вещества нестойких соединений переменного состава – сольватов (химический процесс). Если растворителем служит вода, то эти соединения называют гидратами.
Образование растворов является процессом самопроизвольным, идущим с увеличением беспорядка системы, т.е. с повышением энтропии. Например, при растворении кристалла система из полностью упорядоченного состояния переходит в менее упорядоченное. При этом с увеличением энтропии (AS > 0) уменьшается свободная энергия системы (AG <0).
Если раствор образуется из 2 жидкостей, то движущая сила процесса растворения обусловлена стремлением компонентов раствора к выравниванию концентраций, что также приводит к увеличению энтропии, т.е. AS > 0, a AQ < 0. Растворение вещества – процесс обратимый. И как всякий обратный процесс, растворение заканчивается установлением динамического равновесия: нерастворенное вещество – вещество в растворе. Раствор, находящийся в равновесии с растворяющимся веществом, называют насыщенным раствором, а достигнутую предельную концентрацию насыщенного раствора – растворимостью.
Важнейшей характеристикой раствора является его состав или концентрация компонентов.
Концентрация растворов – количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
Концентрацию растворов можно выражать по-разному. В химической практике наиболее употребительны следующие способы выражения концентраций:
1. Массовая доля растворенного вещества (процентная концентрация) – показывает, сколько граммов вещества растворено в 100 г раствора. Она определяется по формуле:
где W – массовая доля растворенного вещества,
m в-ва – масса растворенного вещества,
m р-ра – масса раствора.
2. Молярная концентрация – показывает, сколько молей растворенного вещества содержится в 1 л раствора.
3. Моляльная концентрация – показывает, сколько молей вещества содержится в 1 кг растворителя.
Растворы газов в жидкостях
Растворимость газов в жидкостях зависит от их природы, природы растворителя, температуры и давления. Как правило, растворимость газа больше, если растворение сопровождается химическим взаимодействием его с растворителем, и меньше, если при этом химического взаимодействия не происходит. Например, в 1 л воды при н.у. растворяется 0,0002 г водорода, не взаимодействующего с водой, и 875 г аммиака, который реагирует с водой с образованием гидроксида аммония.
Зависимость растворимости газов от природы растворителя можно показать на следующих примерах. При одинаковых условиях в 1000 г воды растворяется 87,5 г NH 3 , а в 100 г этилового спирта – только 25 г. Растворимость газов в значительной мере зависит от температуры. При повышении температуры растворимость их уменьшается, а при понижении увеличивается. Так при 0 0 С в 100 мл воды растворяется 171 см 3 СО 2 , при 20 0 С – только 87,8 см 3 . Поэтому длительным кипячением можно почти полностью удалить растворенные газы из жидкости, а насыщение жидкостей газом целесообразно проводить при низких температурах.
Растворимость газа зависит также от давления. Зависимость растворимости газа от давления определяется законом Генри .
С = к · р, (4.2)
где С – концентрация газа в растворе,
к – коэффициент пропорциональности, зависящий от природы жидкости и газа,
р – давление газа над раствором.
Масса растворенного газа при постоянной температуре прямо пропорциональна давлению газа над раствором.
Закон Генри справедлив только для разбавленных растворов в условиях низких давлений. Газы, вступающие во взаимодействие с растворителем NH 3 , SO 2 , HC1 с водой, закону Генри не подчиняются. Их растворимость также увеличивается с повышением давления, но по более сложному закону.
Проявление закона Генри иллюстрируется образованием обильной пены при откупоривании бутылки с газированной водой или бутылки с шампанским; здесь происходит резкое уменьшение растворимости газа при понижении его парциального давления. Этот же закон объясняет возникновение кессонной болезни. На глубине 40 м ниже уровня моря общее давление составляет 600 кПа и растворимость азота в плазме крови в 9 раз больше, чем на поверхности моря. При быстром подъеме водолаза с глубины растворенный азот выделяется в кровь пузырьками, которые закупоривают кровеносные сосуды, что может привести к тяжелым последствиям.
Растворимость газа уменьшается при наличии в растворе третьего компонента. Так, в растворах электролитов газы растворяются значительно хуже, чем в чистой воде. Например, в 1 г воды при 0 0 С растворяется 3 · 10 3 м 3 хлора, а в 1 г насыщенного раствора NaCl растворяется в 10 раз меньше, поэтому при хранении хлора над жидкостью воду заменяют на раствор хлорида натрия.
Тема: Растворы. Типы растворовЦели урока:
Обучающие : начать формировать понятие о растворе, познакомить учащихся с растворением как физико-химическим процессом и растворами как физико-химическими процессами, показать зависимость растворимости твердых веществ от температуры, дать классификацию растворов по признаку растворимости, сформировать наглядное представление о процессах, происходящих в растворах,.
Развивающие : развивать логическое мышление, память, умение сравнивать; развивать умения и навыки познавательной деятельности учащихся;
Воспитательные : внимание в процессе демонстрации химических опытов; повышать интерес учащихся к предмету.
Тип урока : усвоения новых знаний. Включение учащихся в активную языковую деятельность. 2. Стремление к грамотному общению.
Методы и формы обучения: рассказ учителя, фронтальная беседа, демонстрация опытов, рассказ с элементами беседы.
Оборудование и реактивы : периодическая система химических элементов Д. И. Менделеева; таблица «Растворимость кислот, щелочей, солей»; набор химических реактивов: вода, мел, песок, сахар, NaCl, подсолнечное масло, яичный белок.
ХОД УРОКА
ОРГАНИЗАЦИОННЫЙ МОМЕНТ
Приветствие, проверка готовности класса к уроку.
ІІ. АКТУАЛИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ
Учитель. Из курса природоведения и повседневной жизни вам известно, что в воде растворяется много веществ. При этом образуются растворы. Растворы – играют важную роль в нашей жизни, с ними каждый из нас постоянно сталкивается как в быту, так и на производстве. Да и сам организм человека содержит растворы самых разных веществ. Рассмотрим особенности растворов, а также поведение различных веществ в них.
ІІІ. МОТИВАЦИЯ УЧЕБНОЙ ДЕЯТЕЛЬНОСТИ
А что же представляют собой растворы и каково их значение для человека? Какую роль они играют в природе? Это мы узнаем на сегодняшнем уроке.
IV .СООБЩЕНИЕ ТЕМЫ, ЦЕЛЕЙ И ЗАДАЧ УРОКА
Изучить: понятие растворы и их классификацию;
Научиться составлять уравнения химических реакций, характеризующих свойства спиртов
V. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Учитель. Вам известно, что при смешивании веществ с водой образуются однородные системы (растворы).
Пример. Сахар или соль растворяются в воде. Образуется однородная система - раствор.
Вопрос. А если песок растворить в воде? Образуется неоднородная система, так как песок плохо растворяется в воде. Процесс растворения веществ в воде - это не только физическое явление. Из практики вам известно, что при растворении многих веществ в воде, например серной кислоты, происходит разогревание. Выделение теплоты - это признак химической реакции.
Отсюда - определение.
Растворы - однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
При растворении вещества измельчаются, дробятся. Поэтому растворы относятся к дисперсным системам.
Слово «диспергирование» означает дробление. Самое большое значение имеют дисперсные системы, в которых средой является вода и другие жидкости.
Дисперсные системы делятся на следующие виды:
истинные растворы;
коллоидные растворы;
грубодисперсные системы.
Рассмотрим подробно, что представляют собой эти растворы.
І. Истинные растворы
Истинные растворы однородные, частицы рас творенного вещества маленькие, меньше 1 нм ( 1 н м = 1 0 - 9 м ) , их нельзя выявить даже с помощью ультрамикроскопа.
Задание. Привести примеры истинных растворов. Демонстрация.
К истинным растворам относятся растворы сахара, соли в воде.
ІІ. Коллоидные растворы
Примеры. Раствор яичного белка, силикатного клея.
Демонстрация.
Они прозрачные, как истинные растворы, но размер частиц растворенного вещества больше - от 1 до 100 нм.
Эти частицы состоят из множества молекул, способны рассеивать свет, проходящий через эти растворы. Отдельные частицы выявляют с помощью ультрамикроскопа.
Слипание коллоидных частиц называется коагуляцией. При этом образуется гель - желеобразная масса (желе, мармелад, холодец).
ІІІ. Грубодисперсные системы
При смешивании некоторых веществ с водой образуются не растворы, а мутные смеси, которые называют взвесями (суспензии).
Они делятся на суспензии, эмульсии и аэрозоли.
Суспензии - это взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды.
Примеры: глина, песок с водой. Демонстрация.
Эмульсии - взвеси, в которых мелкие капельки жидкости равномерно распределены между молекулами другой жидкости.
Примеры: растительное масло с водой, керосин с водой.
Демонстрация.
Аэрозоли - взвеси, в которых мелкие частицы твердого вещества или жидкости равномерно распределены в газовой среде.
Примеры: пыль в воздухе, туман.
Мы рассмотрели разные виды дисперсных систем.
А где же в жизни человеку встречаются растворы? И какое они имеют значение в природе и жизни человека?
Растворы человеку встречаются в быту, медицине, природе, на химическом производстве и т. п. В быту - это растворы соли, сахара в воде, столовый уксус - раствор уксусной кислоты в воде, газированная вода - раствор CO 2 в H 2 O и т. д.
В медицине - растворы лекарственных препаратов для инъекций, микстуры и т. п.
В сельском хозяйстве, химической промышленности, авто- и авиапромышленности и т. п. значение растворов также огромно.
В парфюмерии широко применяют различные эмульсии и аэрозоли.
В строительстве - грубодисперсные системы (растворы песка, мела, цемента и т. д.), имеющие важное значение для этой отрасли народного хозяйства.
Такие примеры можно приводить бесконечно, так как в воде растворяется много твердых веществ, газов и жидкостей.
VI. ДОМАШНЕЕ ЗАДАНИЕ
Выучить § . Подготовить сообщение: значение растворов в природе и жизни человека.
VII. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА
Изучив эту тему, повторим некоторые важные моменты.
Вопросы учащимся
Что такое растворы?
На какие группы делятся растворы? Привести примеры.
Какое значение имеют растворы для человека?
Где в природе вам встречались растворы и каково их значение?
VIII . ПОДВЕДЕНИЕ ИТОГОВ РАБОТЫ, ВЫСТАВЛЕНИЕ ОЦЕНОЧНЫХ БАЛЛОВ