समाधान प्रकृति, विज्ञान और प्रौद्योगिकी में महत्वपूर्ण भूमिका निभाते हैं। जल जीवन का आधार है, इसमें हमेशा विलेय होते हैं। नदियों और झीलों के ताजे पानी में कुछ घुले हुए पदार्थ होते हैं, जबकि समुद्र के पानी में लगभग 3.5% घुले हुए लवण होते हैं।
प्राथमिक महासागर (पृथ्वी पर जीवन की उत्पत्ति के समय), मान्यताओं के अनुसार, केवल 1% भंग लवण होते हैं।
"यह इस वातावरण में था कि जीवित जीवों ने पहली बार विकसित किया, इस समाधान से उन्होंने आयनों और अणुओं को स्कूप किया जो उनके आगे के विकास और विकास के लिए जरूरी हैं ... समय के साथ, जीवित जीव विकसित और परिवर्तित हो गए, इसलिए वे जलीय पर्यावरण को छोड़ने में सक्षम थे। और भूमि पर जाएँ और फिर हवा में उठें। उन्होंने अपने जीवों में तरल पदार्थ के रूप में एक जलीय घोल का भंडारण करके इन क्षमताओं को प्राप्त किया, जिसमें आयनों और अणुओं की एक महत्वपूर्ण आपूर्ति होती है "- ये ऐसे शब्द हैं जिनका उपयोग प्रकृति में समाधान की भूमिका का वर्णन करने के लिए किया जाता है, प्रसिद्ध अमेरिकी रसायनज्ञ, नोबेल पुरस्कार पुरस्कार विजेता लिनुस पॉलिंग। हम में से प्रत्येक के अंदर, हमारे शरीर की हर कोशिका में, आदिकालीन महासागर की यादें हैं, वह स्थान जहाँ जीवन की उत्पत्ति हुई - एक जलीय घोल जो स्वयं जीवन प्रदान करता है।
किसी भी जीवित जीव में, एक असामान्य समाधान लगातार वाहिकाओं - धमनियों, नसों और केशिकाओं के माध्यम से बहता है - जो रक्त का आधार बनाते हैं, इसमें लवण का द्रव्यमान अंश प्राथमिक महासागर के समान होता है - 0.9%। मानव और पशु शरीर में जटिल भौतिक-रासायनिक प्रक्रियाएं भी समाधानों में परस्पर क्रिया करती हैं। भोजन को आत्मसात करने की प्रक्रिया अत्यधिक पौष्टिक पदार्थों के घोल में स्थानांतरण से जुड़ी है। प्राकृतिक जलीय घोल मिट्टी के निर्माण, पौधों की आपूर्ति की प्रक्रियाओं से सीधे संबंधित हैं पोषक तत्त्व... रासायनिक और कई अन्य उद्योगों में ऐसी तकनीकी प्रक्रियाएं, उदाहरण के लिए, उर्वरक, धातु, एसिड, कागज का उत्पादन, समाधान में होता है। आधुनिक विज्ञानसमाधान के गुणों का अध्ययन कर रहा है। आइए जानते हैं क्या है उपाय?
 समाधान अन्य मिश्रणों से भिन्न होते हैं, जिसमें घटक भागों के कण समान रूप से वितरित होते हैं, और इस तरह के मिश्रण के किसी भी माइक्रोवॉल्यूम में संरचना समान होगी।
समाधान अन्य मिश्रणों से भिन्न होते हैं, जिसमें घटक भागों के कण समान रूप से वितरित होते हैं, और इस तरह के मिश्रण के किसी भी माइक्रोवॉल्यूम में संरचना समान होगी।
यही कारण है कि समाधान को सजातीय मिश्रण के रूप में समझा जाता था जिसमें दो या दो से अधिक सजातीय भाग होते हैं। यह विचार समाधान के भौतिक सिद्धांत पर आधारित था।
समाधान के भौतिक सिद्धांत के अनुयायी, जो वानट हॉफ, अरहेनियस और ओस्टवाल्ड में लगे हुए थे, का मानना था कि विघटन की प्रक्रिया प्रसार का परिणाम है।
डीआई मेंडेलीव और रासायनिक सिद्धांत के समर्थकों का मानना था कि विघटन पानी के अणुओं के साथ एक विलेय की रासायनिक बातचीत का परिणाम है। इस प्रकार, एक समाधान को एक सजातीय प्रणाली के रूप में परिभाषित करना अधिक सटीक होगा, जिसमें एक विलेय के कण, एक विलायक, और उनकी बातचीत के उत्पाद भी होते हैं।
पानी के साथ एक विलेय की रासायनिक बातचीत के कारण यौगिक बनते हैं - हाइड्रेट्स। रासायनिक बातचीत आमतौर पर थर्मल घटना के साथ होती है। उदाहरण के लिए, पानी में सल्फ्यूरिक एसिड का विघटन इतनी बड़ी मात्रा में गर्मी के निकलने के साथ होता है कि घोल उबल सकता है, यही वजह है कि एसिड को पानी में डाला जाता है, न कि इसके विपरीत। सोडियम क्लोराइड, अमोनियम नाइट्रेट जैसे पदार्थों का विघटन गर्मी अवशोषण के साथ होता है।
एमवी लोमोनोसोव ने साबित किया कि समाधान एक विलायक की तुलना में कम तापमान पर बर्फ में बदल जाते हैं।
www.site, सामग्री की पूर्ण या आंशिक प्रतिलिपि के साथ, स्रोत के लिए एक लिंक की आवश्यकता है।
विषय: पानी और समाधान।
योजना:
- प्रकृति में जल। जल गुण।
- समाधान।
- समाधान की संरचना को व्यक्त करने के तरीके।
- हाइड्रेट्स और क्रिस्टलीय हाइड्रेट्स।
- घुलनशीलता।
- सुपरसैचुरेटेड घोल।
- परासरण।
- वाष्प दबाव, समाधान।
- घोल का जमना और उबालना।
- प्रतिरोधी विलयन।
जल "पृथ्वी पर एक बहुत व्यापक पदार्थ है। लगभग तीनदुनिया की चौथी सतह पानी से ढकी हुई है, जिससे महासागर, समुद्र, नदियाँ और झीलें बनती हैं। बहुत सारा पानी वायुमण्डल में वाष्प के रूप में गैसीय अवस्था में होता है; बर्फ और बर्फ के विशाल द्रव्यमान के रूप में, यह पूरे वर्ष ऊंचे पहाड़ों की चोटी पर और ध्रुवीय देशों में रहता है। पृथ्वी की आंतों में, पानी भी है जो मिट्टी और चट्टानों में प्रवेश करता है।
प्राकृतिक जल कभी भी पूर्णतः स्वच्छ नहीं होता है। सबसे शुद्ध वर्षा जल है, लेकिन इसमें विभिन्न अशुद्धियों की थोड़ी मात्रा भी होती है जिसे यह हवा से पकड़ लेता है।
मीठे पानी में अशुद्धियों की मात्रा आमतौर पर 0.01 से 0.1% (द्रव्यमान) तक होती है। समुद्र के पानी में घुले हुए पदार्थों का 3.5% (द्रव्यमान) होता है, जिसका मुख्य द्रव्यमान सोडियम क्लोराइड (टेबल सॉल्ट) होता है।
पानी जिसमें महत्वपूर्ण मात्रा में कैल्शियम और मैग्नीशियम लवण होते हैं, उसे कठोर जल कहा जाता है, जबकि शीतल जल जैसे वर्षा जल के विपरीत। कठोर जल साबुन के साथ थोड़ा झाग देता है, और बॉयलरों की दीवारों पर स्केल बनाता है।
इसमें निलंबित कणों से प्राकृतिक पानी को मुक्त करने के लिए, इसे झरझरा पदार्थ की एक परत के माध्यम से फ़िल्टर किया जाता है, उदाहरण के लिए, कोयला, जली हुई मिट्टी, आदि। बड़ी मात्रा में पानी को छानते समय, रेत और बजरी से बने फिल्टर का उपयोग किया जाता है। फिल्टर अधिकांश जीवाणुओं को भी फँसाते हैं। इसके अलावा, कीटाणुशोधन के लिए पीने का पानीयह क्लोरीनयुक्त है; पानी की पूर्ण नसबंदी के लिए प्रति 1 टन पानी में 0.7 ग्राम क्लोरीन से अधिक की आवश्यकता नहीं होती है।
निस्पंदन पानी से केवल अघुलनशील अशुद्धियों को हटा सकता है। आसवन (आसवन) या आयन एक्सचेंज द्वारा इसमें से घुले हुए पदार्थ निकाले जाते हैं।
पानी पौधों, जानवरों और मनुष्यों के जीवन में बहुत महत्वपूर्ण है। आधुनिक विचारों के अनुसार जीवन की उत्पत्ति समुद्र से ही जुड़ी हुई है। किसी भी जीव में, पानी एक ऐसा वातावरण है जिसमें रासायनिक प्रक्रियाएं होती हैं जो जीव की महत्वपूर्ण गतिविधि को सुनिश्चित करती हैं; इसके अलावा, वह स्वयं कई जैव रासायनिक प्रतिक्रियाओं में भाग लेती है।
पानी के भौतिक गुण। शुद्ध जलएक रंगहीन पारदर्शी तरल है। एक ठोस से एक तरल अवस्था में संक्रमण के दौरान पानी का घनत्व कम नहीं होता है, जैसा कि लगभग
अन्य सभी पदार्थों के लिए, लेकिन बढ़ता है। जब पानी को 0 से 4°C तक गर्म किया जाता है तो उसका घनत्व भी बढ़ जाता है। 4 डिग्री सेल्सियस पर, पानी का घनत्व अधिकतम होता है, और केवल आगे गर्म करने पर इसका घनत्व कम हो जाता है।
प्रकृति के जीवन में बहुत महत्व इस तथ्य का है कि पानी में असामान्य रूप से उच्च ताप क्षमता होती है।
इस तथ्य के कारण कि जब बर्फ पिघलती है, तो पानी का आयतन कम हो जाता है, दबाव बर्फ के गलनांक को कम कर देता है। यह ले चेटेलियर के सिद्धांत से चलता है। इस प्रकार 0°C पर दाब बढ़ने से बर्फ का द्रव में परिवर्तन हो जाता है, जिसका अर्थ है कि बर्फ का गलनांक कम हो जाता है।
पानी के अणु में कोणीय संरचना होती है; इसके नाभिक एक समद्विबाहु त्रिभुज बनाते हैं, जिसके आधार पर दो प्रोटॉन होते हैं, और शीर्ष पर - एक ऑक्सीजन परमाणु का नाभिक। O - H की आंतरिक दूरी 0.1 एनएम के करीब है, हाइड्रोजन परमाणुओं के नाभिक के बीच की दूरी लगभग 0.15 एनएम है। पानी के अणु में ऑक्सीजन परमाणु की बाहरी इलेक्ट्रॉन परत बनाने वाले आठ इलेक्ट्रॉनों में से दो इलेक्ट्रॉन जोड़े सहसंयोजक ओ-एच बांड बनाते हैं, और शेष चार इलेक्ट्रॉन दो असंबद्ध इलेक्ट्रॉन जोड़े होते हैं।
पानी के अणु में ऑक्सीजन परमाणु 5p अवस्था में होता है 3 -संकरण। इसलिए, बंधन कोण НОН (104.3 °) टेट्राहेड्रल (109.5 °) के करीब है। O-H बंध बनाने वाले इलेक्ट्रॉनों को अधिक विद्युत ऋणात्मक ऑक्सीजन परमाणु की ओर विस्थापित किया जाता है। नतीजतन, हाइड्रोजन परमाणु प्रभावी सकारात्मक चार्ज प्राप्त करते हैं, जिससे इन परमाणुओं पर दो सकारात्मक ध्रुव बनते हैं। संकर 5p . पर स्थित ऑक्सीजन परमाणु के एकाकी इलेक्ट्रॉन युग्मों के ऋणात्मक आवेशों के केंद्र 3 -ऑर्बिटल्स परमाणु नाभिक के सापेक्ष विस्थापित होते हैं और दो नकारात्मक ध्रुव बनाते हैं।
वाष्पशील जल का आणविक भार 18 इकाई होता है। लेकिन अन्य सॉल्वैंट्स में इसके समाधानों का अध्ययन करके निर्धारित तरल पानी का आणविक भार अधिक, अधिक होता है। यह इस तथ्य के कारण है कि तरल पानी में व्यक्तिगत पानी के अणुओं का अधिक जटिल समुच्चय (समूहों) में जुड़ाव होता है। इस निष्कर्ष की पुष्टि पानी के गलनांक और क्वथनांक के असामान्य रूप से उच्च मूल्यों से भी होती है। पानी के अणुओं का जुड़ाव उनके बीच हाइड्रोजन बांड के बनने के कारण होता है।
इसकी संरचना से, पानी नियमित वॉल्यूमेट्रिक संरचनाओं का एक पदानुक्रम है, जो क्रिस्टल जैसी संरचनाओं पर आधारित होता है, जिसमें 57 अणु होते हैं और मुक्त हाइड्रोजन बांड के कारण एक दूसरे के साथ बातचीत करते हैं। यह षट्भुज के रूप में दूसरे क्रम की संरचनाओं की उपस्थिति की ओर जाता है, जिसमें 912 पानी के अणु होते हैं। गुच्छों के गुण सतह पर ऑक्सीजन और हाइड्रोजन के अनुपात पर निर्भर करते हैं। जल तत्वों का विन्यास किसी भी बाहरी प्रभाव और अशुद्धियों पर प्रतिक्रिया करता है, जो उनकी बातचीत की अत्यंत अस्थिर प्रकृति की व्याख्या करता है। साधारण पानी में, व्यक्तिगत पानी के अणुओं और यादृच्छिक सहयोगियों का कुल 60% (विनाशकारी पानी) होता है, और 40% क्लस्टर (संरचित पानी) होता है।
ठोस जल (बर्फ) में, प्रत्येक अणु का ऑक्सीजन परमाणु पड़ोसी जल अणुओं के साथ दो हाइड्रोजन बंधों के निर्माण में भाग लेता है। हाइड्रोजन बंधों के बनने से जल के अणुओं की ऐसी व्यवस्था हो जाती है जिसमें वे एक दूसरे को अपने विपरीत ध्रुवों से स्पर्श करते हैं। अणु परतें बनाते हैं, जिनमें से प्रत्येक एक ही परत से संबंधित तीन अणुओं से जुड़ा होता है, और एक आसन्न परत से होता है। बर्फ की संरचना सबसे कम घनी संरचनाओं से संबंधित होती है, इसमें रिक्तियां होती हैं, जिनके आयाम अणु के आकार से कुछ बड़े होते हैं।
जब बर्फ पिघलती है तो उसकी संरचना नष्ट हो जाती है। लेकिन तरल पानी में भी, अणुओं के बीच हाइड्रोजन बांड संरक्षित होते हैं: सहयोगी बनते हैं - बर्फ संरचनाओं के टुकड़े - पानी के अणुओं की एक बड़ी या छोटी संख्या से मिलकर। हालांकि, बर्फ के विपरीत, प्रत्येक सहयोगी बहुत कम समय के लिए मौजूद होता है: कुछ का विनाश और अन्य समुच्चय का गठन लगातार होता है। एकल पानी के अणु ऐसे "बर्फ" समुच्चय के रिक्त स्थान में स्थित हो सकते हैं; ऐसे में पानी के अणुओं की पैकिंग सघन हो जाती है। इसीलिए, जब बर्फ पिघलती है, तो पानी का आयतन कम हो जाता है और उसका घनत्व बढ़ जाता है।
जैसे-जैसे पानी गर्म होता है, उसमें बर्फ की संरचना का मलबा कम होता जाता है, जिससे पानी के घनत्व में और वृद्धि होती है। 0 से 4 डिग्री सेल्सियस के तापमान में, यह प्रभाव थर्मल विस्तार पर प्रबल होता है, जिससे पानी का घनत्व बढ़ता रहता है। हालांकि, जब 4 डिग्री सेल्सियस से ऊपर गरम किया जाता है, तो अणुओं की बढ़ी हुई तापीय गति का प्रभाव प्रबल होता है और पानी का घनत्व कम हो जाता है। अतः 4°C पर जल का घनत्व अधिकतम होता है।
जब पानी को गर्म किया जाता है, तो गर्मी का कुछ हिस्सा हाइड्रोजन बॉन्ड को तोड़ने पर खर्च होता है (पानी में हाइड्रोजन बॉन्ड को तोड़ने की ऊर्जा लगभग 25 kJ/mol है)। यह पानी की उच्च ताप क्षमता की व्याख्या करता है। पानी के अणुओं के बीच हाइड्रोजन बांड पूरी तरह से तभी टूटते हैं जब पानी भाप में गुजरता है।
पानी का राज्य आरेख (या चरण आरेख) प्रणाली की स्थिति और प्रणाली में चरण परिवर्तनों (ठोस से तरल में संक्रमण, तरल से गैसीय, आदि) की विशेषता वाली मात्राओं के बीच संबंध का एक चित्रमय प्रतिनिधित्व है। एक-घटक प्रणालियों के लिए, आमतौर पर चरण आरेखों का उपयोग किया जाता है, जो तापमान और दबाव पर चरण परिवर्तनों की निर्भरता को दर्शाता है; उन्हें पीटी राज्य आरेख कहा जाता है।
इस बिंदु के अनुरूप तापमान पर, महत्वपूर्ण तापमान, तरल और वाष्प के भौतिक गुणों को दर्शाने वाली मात्रा समान हो जाती है, जिससे तरल और वाष्प अवस्था के बीच का अंतर गायब हो जाता है।
एक महत्वपूर्ण तापमान का अस्तित्व 1860 में डी.आई. मेंडेलीव द्वारा तरल पदार्थों के गुणों का अध्ययन करके स्थापित किया गया था। उन्होंने दिखाया कि महत्वपूर्ण तापमान से ऊपर के तापमान पर, कोई पदार्थ तरल अवस्था में नहीं हो सकता। 1869 में एंड्रयूज ने गैसों के गुणों का अध्ययन करते हुए इसी तरह के निष्कर्ष पर पहुंचे।
विभिन्न पदार्थों के लिए महत्वपूर्ण तापमान और दबाव अलग-अलग होते हैं। तो, हाइड्रोजन के लिए = -239.9 डिग्री सेल्सियस, = 1.30 एमपीए, क्लोरीन के लिए = 144 डिग्री सेल्सियस, = 7.71 एमपीए, पानी के लिए = 374.2 डिग्री सेल्सियस, = 22.12 एमपीए।
पानी के अणु गर्मी के प्रति अत्यधिक प्रतिरोधी होते हैं। हालांकि, 1000 डिग्री सेल्सियस से ऊपर के तापमान पर, जल वाष्प हाइड्रोजन और ऑक्सीजन बनाने वाले पानी में विघटित होना शुरू हो जाता है। किसी पदार्थ के गर्म होने पर उसके अपघटन की प्रक्रिया को ऊष्मीय वियोजन कहते हैं। पानी का ऊष्मीय पृथक्करण ऊष्मा अवशोषण के साथ होता है। इसलिए, फ्रांसीसी वैज्ञानिक ले चेटेलियर के संतुलन के सिद्धांत के अनुसार, तापमान जितना अधिक होगा, पानी उतना ही अधिक विघटित होगा। हालांकि, 2000 डिग्री सेल्सियस पर भी, पानी के थर्मल पृथक्करण की डिग्री 2% से अधिक नहीं होती है, अर्थात। गैसीय पानी और इसके पृथक्करण के उत्पादों - हाइड्रोजन और ऑक्सीजन के बीच संतुलन अभी भी पानी की ओर स्थानांतरित होता है। 1000 डिग्री सेल्सियस से नीचे ठंडा होने पर, संतुलन इस दिशा में लगभग पूरी तरह से स्थानांतरित हो जाता है।
पानी एक अत्यधिक प्रतिक्रियाशील पदार्थ है। कई धातुओं और अधातुओं के ऑक्साइड पानी के साथ मिलकर क्षार और अम्ल बनाते हैं; कुछ लवण जल के साथ क्रिस्टलीय हाइड्रेट बनाते हैं; सबसे सक्रिय धातुएं हाइड्रोजन के विकास के साथ पानी के साथ परस्पर क्रिया करती हैं।
पानी में उत्प्रेरक गुण भी होते हैं। नमी के निशान की अनुपस्थिति में, कुछ सामान्य प्रतिक्रियाएं व्यावहारिक रूप से नहीं होती हैं; उदाहरण के लिए, क्लोरीन धातुओं के साथ बातचीत नहीं करता है, हाइड्रोजन फ्लोराइड कांच को खराब नहीं करता है, सोडियम हवा में ऑक्सीकरण नहीं करता है।
पानी कई पदार्थों के साथ संयोजन करने में सक्षम है जो गैसीय अवस्था में सामान्य परिस्थितियों में होते हैं, तथाकथित गैस हाइड्रेट बनाते हैं। उदाहरण क्सीनन, क्लोरीन और हाइड्रोकार्बन के यौगिक हैं, जो 0 से 24 डिग्री सेल्सियस (आमतौर पर संबंधित गैस के ऊंचे दबाव पर) के तापमान पर क्रिस्टल के रूप में अवक्षेपित होते हैं। इस तरह के यौगिक पानी की संरचना ("होस्ट") में गैस अणुओं ("अतिथि") के साथ अंतर-आणविक गुहाओं को भरने के परिणामस्वरूप उत्पन्न होते हैं; उन्हें समावेशन यौगिक या क्लैथ्रेट कहा जाता है।
क्लैथ्रेट यौगिकों में, "अतिथि" और "होस्ट" अणुओं के बीच केवल कमजोर अंतर-आणविक बंधन बनते हैं; शामिल अणु क्रिस्टल गुहा में अपना स्थान नहीं छोड़ सकते हैं, मुख्यतः स्टेरिक बाधाओं के कारण। इसलिए, क्लैथ्रेट अस्थिर यौगिक हैं जो केवल अपेक्षाकृत कम तापमान पर मौजूद हो सकते हैं।
क्लैथ्रेट का उपयोग हाइड्रोकार्बन और उत्कृष्ट गैसों को अलग करने के लिए किया जाता है। हाल ही में, पानी के विलवणीकरण के लिए गैस क्लैथ्रेट (प्रोपेन और कुछ अन्य) के गठन और विनाश का सफलतापूर्वक उपयोग किया गया है। उच्च दाब पर खारे पानी में उपयुक्त गैस डालने से बर्फ जैसे क्लेथ्रेट क्रिस्टल प्राप्त होते हैं, जबकि लवण विलयन में रहते हैं। क्रिस्टल के बर्फ जैसे द्रव्यमान को मदर लिकर से अलग किया जाता है और धोया जाता है। फिर, तापमान में मामूली वृद्धि या दबाव में कमी के साथ, क्लैथ्रेट विघटित हो जाते हैं, जिससे ताजा पानी और मूल गैस बनती है, जिसका उपयोग फिर से क्लैथ्रेट प्राप्त करने के लिए किया जाता है . इस प्रक्रिया के कार्यान्वयन के लिए उच्च दक्षता और अपेक्षाकृत हल्की स्थितियां इसे समुद्री जल के विलवणीकरण के लिए एक औद्योगिक विधि के रूप में आशाजनक बनाती हैं।
एक समाधान एक ठोस या तरल सजातीय प्रणाली है जिसमें दो या दो से अधिक घटक (घटक) होते हैं, जिनकी सापेक्ष मात्रा विस्तृत सीमाओं के भीतर भिन्न हो सकती है।
प्रत्येक विलयन में विलेय और एक विलायक होता है, अर्थात्। वातावरण जिसमें ये पदार्थ अणुओं या आयनों के रूप में समान रूप से वितरित होते हैं। आमतौर पर, विलायक को वह घटक माना जाता है जो परिणामी समाधान के रूप में एकत्रीकरण की उसी स्थिति में अपनी शुद्ध अवस्था में मौजूद होता है (उदाहरण के लिए, एक जलीय नमक समाधान के मामले में, विलायक, निश्चित रूप से, पानी है)। यदि विघटन से पहले दोनों घटक एकत्रीकरण की एक ही स्थिति में थे (उदाहरण के लिए, शराब और पानी), तो जो घटक अधिक मात्रा में होता है उसे विलायक माना जाता है।
समाधानों की एकरूपता उन्हें रासायनिक यौगिकों के समान बनाती है। कुछ पदार्थों के विघटन के दौरान गर्मी की रिहाई भी विलायक और पदार्थ के भंग होने के बीच एक रासायनिक बातचीत को इंगित करती है। समाधान और रासायनिक यौगिकों के बीच का अंतर यह है कि समाधान की संरचना व्यापक सीमाओं के भीतर भिन्न हो सकती है।
इसके अलावा, इसके व्यक्तिगत घटकों के कई गुण एक समाधान के गुणों में पाए जा सकते हैं, जो कि रासायनिक यौगिक के मामले में नहीं देखा जाता है। समाधानों की संरचना की अनिश्चितता उन्हें यांत्रिक मिश्रणों के करीब लाती है, लेकिन वे अपनी समरूपता में उत्तरार्द्ध से काफी भिन्न होते हैं।
इस प्रकार, समाधान यांत्रिक मिश्रण और रासायनिक यौगिकों के बीच एक मध्यवर्ती स्थिति पर कब्जा कर लेते हैं।
एक तरल में क्रिस्टल का विघटन निम्नानुसार होता है। जब एक क्रिस्टल को एक तरल में पेश किया जाता है जिसमें वह घुल सकता है, तो अलग-अलग अणु इसकी सतह से अलग हो जाते हैं। उत्तरार्द्ध, प्रसार के कारण, विलायक की मात्रा में समान रूप से वितरित किए जाते हैं। एक ठोस की सतह से अणुओं का पृथक्करण एक ओर, उनकी अपनी कंपन गति के कारण होता है, और दूसरी ओर, विलायक के अणुओं के आकर्षण के कारण होता है।
फिर एक गतिशील संतुलन स्थापित किया जाता है, जिसमें समाधान से मुक्त होने पर प्रति इकाई समय में जितने अणु घुलते हैं।
दौड़ के साथ संतुलन में एक समाधान घुलने वाले पदार्थ को संतृप्त विलयन कहते हैं।
संतृप्त समाधानों का उपयोग अपेक्षाकृत कम ही किया जाता है। ज्यादातर मामलों में, असंतृप्त समाधान का उपयोग किया जाता है जिसमें किसी दिए गए तापमान पर संतृप्त समाधान की तुलना में कम विलेय होता है। इस मामले में, कम विलेय सामग्री वाले समाधानों को तनु कहा जाता है, जिसमें उच्च - केंद्रित होता है।
समाधान की संरचना (और, विशेष रूप से, इसमें विलेय की सामग्री) व्यक्त की जा सकती है विभिन्न तरीके- दोनों आयामहीन इकाइयों (अंश या प्रतिशत) की मदद से, और आयामी मात्राओं के माध्यम से - एकाग्रता।
समाधानों की संरचना को व्यक्त करने के तरीके
|
नाम और प्रतीक |
परिभाषा |
आयाम |
ध्यान दें |
|
|
विलेय B, w (B) का द्रव्यमान अंश |
विलेय B (mB) के द्रव्यमान का विलयन के द्रव्यमान (mP) से अनुपात। |
आयामहीन मात्रा |
|
१०० मास एच में समाधान में 20 द्रव्यमान होते हैं। NaOH सहित |
|
विलेय B का मोलर अंश, xB fraction |
दूसरे पदार्थ (nB) की मात्रा का अनुपात, विलायक सहित घोल बनाने वाले सभी पदार्थों की कुल मात्रा से (ई नी = एनबी + एन 1 + एन 2 + ... नी) |
आयामहीन मात्रा |
एक्सएचसीएल = 0.02 या एक्सएचसीएल = 2% - |
|
|
समाधान में पदार्थ बी की मोलरता, सेमी (बी) |
विलेय B (nB) की मात्रा का किग्रा ( में विलायक (mB) के द्रव्यमान से अनुपात |
मोल / किग्रा = एमएन |
|
सी एम (एच 2 एसओ 4) = 0.1 मोल / किग्रा सी एम (एच 2 एसओ 4) = 0.1 एमएन 1 किलो H2 O के घोल में H2 SO4 का 0.1 mol है। विलयन को दशमलव कहते हैं |
|
पदार्थ बी की दाढ़ एकाग्रता, सीबी concentration |
विलेय B (nB) की मात्रा का विलयन के आयतन (VР) से अनुपात |
मोल / एल = एम |
|
सी (केसीएल) = 2 मोल / एल 1 लीटर घोल में 2 mol KCl . होता है |
|
पदार्थ बी, सीईसी (बी) के समकक्षों की दाढ़ एकाग्रता |
विलेय B (neq) के तुल्यांकों की संख्या का विलयन के आयतन (VР) से अनुपात |
मोल / एल = एन |
|
सी ईक (ना 2 सीओ 3) = 0.01 मोल / एल सी ईक (ना 2 सीओ 3) = 0.01 एन 1 लीटर घोल में 0.01 mol Na2 CO3 समकक्ष - सेंटिमोलर घोल होता है |
|
घोल के आयतन (VР) द्वारा पदार्थ B (Ceq (B)) के समकक्षों की दाढ़ सांद्रता का उत्पाद इस पदार्थ (neq (B)) के समकक्षों की संख्या के बराबर है। इसलिए, समकक्षों का नियम: समाधान के लिए neq (A) + neeq (B) का रूप है: सी ईक (ए) वी पी (ए) = सी ईक (बी) वी पी (बी)। यह समीकरण अक्सर गणनाओं में प्रयोग किया जाता है, खासकर विश्लेषणात्मक रसायन शास्त्र में। |
||||
|
पदार्थ बी समाधान अनुमापांक |
समाधान के 1 मिलीलीटर में निहित पदार्थ बी (एमबी) के द्रव्यमान के बराबर मानक समाधान की एकाग्रता |
|
टी (NaCl) = 0.0250 ग्राम / मिली 1 मिलीलीटर घोल में 0.0250 ग्राम NaCl . होता है |
|
क्रिस्टलीय अवस्था में अधिकांश पदार्थ ऊष्मा अवशोषण के साथ तरल पदार्थों में घुल जाते हैं। हालांकि, जब सोडियम हाइड्रॉक्साइड, पोटेशियम कार्बोनेट, निर्जल कॉपर सल्फेट और कई अन्य पदार्थ पानी में घुल जाते हैं, तो तापमान में उल्लेखनीय वृद्धि होती है। जब कुछ तरल पदार्थ और सभी गैसें पानी में घुल जाती हैं तो गर्मी भी निकलती है।
किसी पदार्थ के एक मोल के विघटन के दौरान अवशोषित (या मुक्त) ऊष्मा की मात्रा को इस पदार्थ के विघटन की ऊष्मा कहते हैं।
यदि विघटन के दौरान ऊष्मा को अवशोषित किया जाता है तो विघटन की ऊष्मा का ऋणात्मक मान होता है, और ऊष्मा निकलने पर धनात्मक मान होता है। उदाहरण के लिए, अमोनियम नाइट्रेट के विघटन की गर्मी -26.4 kJ / mol, पोटेशियम हाइड्रॉक्साइड +55.6 kJ / mol, आदि है।
विघटन प्रक्रिया प्रणाली की एन्ट्रापी में उल्लेखनीय वृद्धि के साथ होती है, क्योंकि एक पदार्थ के कणों के दूसरे में समान वितरण के परिणामस्वरूप, सिस्टम के माइक्रोस्टेट्स की संख्या में तेजी से वृद्धि होती है। इसलिए, अधिकांश क्रिस्टल के विघटन की एंडोथर्मिसिटी के बावजूद, विघटन के दौरान सिस्टम की गिब्स ऊर्जा में परिवर्तन नकारात्मक होता है और प्रक्रिया अनायास ही आगे बढ़ जाती है।
जब क्रिस्टल घुल जाते हैं, तो उनका विनाश होता है, जिसके लिए ऊर्जा की खपत की आवश्यकता होती है। इसलिए, विघटन को गर्मी अवशोषण के साथ करना होगा। यदि विपरीत प्रभाव देखा जाता है, तो यह दर्शाता है कि एक साथ विघटन के साथ, विलायक और भंग पदार्थ के बीच कुछ बातचीत होती है, जिसमें गर्मी के रूप में खपत से अधिक ऊर्जा निकलती है और क्रिस्टल जाली का विनाश होता है।
वास्तव में, अब यह स्थापित हो गया है कि जब कई पदार्थ घुलते हैं, तो उनके अणु (या आयन) विलायक के अणुओं के साथ, सॉल्वैटम नामक यौगिक बनाते हैं और (लैटिन सेसॉल्वर - भंग करना); इस प्रक्रिया को सॉल्वैंशन कहा जाता है। विशेष मामले में, जब विलायक पानी होता है, इन यौगिकों को हाइड्रेट्स कहा जाता है, और उनके गठन की प्रक्रिया को हाइड्रेशन कहा जाता है।
हाइड्रेट्स, एक नियम के रूप में, अस्थिर यौगिक होते हैं, जो कई मामलों में समाधान के वाष्पीकरण पर पहले से ही विघटित हो जाते हैं। लेकिन कभी-कभी हाइड्रेट इतने मजबूत होते हैं कि जब किसी घोल से कोई विलेय निकलता है, तो पानी उसके क्रिस्टल का हिस्सा बन जाता है। पदार्थ, जिसके क्रिस्टल में पानी के अणु शामिल होते हैं, क्रिस्टलीय हाइड्रेट कहलाते हैं, और उनमें निहित पानी को p और - कहा जाता है।साथ टी और एल एल और जेड और जेड और के बारे में और एन के बारे में।
क्रिस्टलीय हाइड्रेट्स की संरचना को आमतौर पर सूत्रों द्वारा दर्शाया जाता है कि क्रिस्टलीकरण पानी में क्रिस्टलीय हाइड्रेट कितना होता है। उदाहरण के लिए, क्रिस्टलीय कॉपर सल्फेट हाइड्रेट (कॉपर सल्फेट)।
क्रिस्टलीय हाइड्रेट्स में पदार्थ और क्रिस्टलीकरण पानी के बीच बंधन शक्ति भिन्न होती है। उनमें से कई कमरे के तापमान पर पहले से ही क्रिस्टलीकरण पानी खो देते हैं। अतः सोडा के पारदर्शी क्रिस्टल (NaC0 .) 3 - 10 एच 2 ओ) आसानी से "अपक्षय" - क्रिस्टलीकरण पानी खोना, सुस्त हो जाना और धीरे-धीरे पाउडर में उखड़ जाना। अन्य क्रिस्टलीय हाइड्रेट्स को निर्जलित करने के लिए काफी मजबूत हीटिंग की आवश्यकता होती है।
घुलनशीलता किसी पदार्थ की किसी विशेष विलायक में घुलने की क्षमता है। दी गई शर्तों के तहत किसी पदार्थ की घुलनशीलता का एक उपाय संतृप्त घोल में इसकी सामग्री है। इसलिए, संख्यात्मक रूप से घुलनशीलता को रचना के समान तरीके से व्यक्त किया जा सकता है, उदाहरण के लिए, एक विलेय के द्रव्यमान का एक संतृप्त घोल के द्रव्यमान का प्रतिशत या एक संतृप्त घोल के 1 लीटर में निहित विलेय की मात्रा। घुलनशीलता अक्सर निर्जल पदार्थ की द्रव्यमान इकाइयों की संख्या से भी व्यक्त की जाती है, जो दी गई शर्तों के तहत, विलायक की 100 द्रव्यमान इकाइयों को संतृप्त करती है; कभी-कभी इस प्रकार व्यक्त विलेयता को विलेयता का गुणांक कहते हैं।
पानी में विभिन्न पदार्थों की घुलनशीलता व्यापक रूप से भिन्न होती है। यदि किसी पदार्थ का १० ग्राम से अधिक १०० ग्राम पानी में घुल जाता है, तो ऐसे पदार्थ को आमतौर पर अत्यधिक घुलनशील कहा जाता है; यदि पदार्थ का 1 ग्राम से कम घुल जाता है, तो यह खराब घुलनशील होता है और अंत में, व्यावहारिक रूप से अघुलनशील होता है, यदि 0.01 ग्राम से कम पदार्थ घोल में गुजरता है।
अधिकांश ठोस पदार्थों का विघटन ऊष्मा के अवशोषण के साथ होता है। यह एक ठोस के क्रिस्टल जाली के विनाश के लिए ऊर्जा की एक महत्वपूर्ण मात्रा के खर्च के कारण होता है, जो आमतौर पर हाइड्रेट्स (सॉल्वेट्स) के निर्माण के दौरान जारी ऊर्जा द्वारा पूरी तरह से मुआवजा नहीं दिया जाता है। क्रिस्टलीय अवस्था में किसी पदार्थ और उसके संतृप्त विलयन के बीच संतुलन के लिए ले चेटेलियर के सिद्धांत को लागू करना
हम इस निष्कर्ष पर पहुंचे हैं कि ऐसे मामलों में जहां कोई पदार्थ ऊर्जा अवशोषण के साथ घुल जाता है, तापमान में वृद्धि से इसकी घुलनशीलता में वृद्धि होनी चाहिए
ऐसे अधिकांश मामलों में, बढ़ते तापमान के साथ, तरल पदार्थों की पारस्परिक घुलनशीलता तब तक बढ़ जाती है जब तक कि एक तापमान तक नहीं पहुंच जाता है, जिस पर दोनों तरल पदार्थ किसी भी अनुपात में मिश्रित हो जाते हैं।
जब ठोस पानी में घुल जाते हैं, तो सिस्टम का आयतन आमतौर पर मामूली रूप से बदल जाता है। इसलिए, ठोस अवस्था में पदार्थों की घुलनशीलता व्यावहारिक रूप से दबाव से स्वतंत्र होती है।
तरल पदार्थ तरल पदार्थों में भी घुल सकते हैं। उनमें से कुछ एक दूसरे में असीम रूप से घुलनशील हैं, अर्थात वे एक दूसरे के साथ किसी भी अनुपात में मिश्रित होते हैं, जैसे, उदाहरण के लिए, शराब और पानी, अन्य - केवल एक निश्चित सीमा तक ही घुलते हैं।
वह तापमान जिस पर द्रवों की सीमित पारस्परिक विलेयता असीमित हो जाती है, क्रांतिक विघटन तापमान कहलाता है
वितरण कानून, जिसके अनुसार दो अमिश्रणीय सॉल्वैंट्स में घुलने में सक्षम पदार्थ को उनके बीच वितरित किया जाता है ताकि इन सॉल्वैंट्स में इसकी सांद्रता का अनुपात स्थिर होविलेय की कुल मात्रा की परवाह किए बिना तापमान स्थिर रहता है:
सी 1 / सी 2 = के
यहां 1 और 2 - पहले और दूसरे सॉल्वैंट्स में विलेय की सांद्रता; / (तथाकथित वितरण गुणांक है।
पानी में गैसों का घुलना एक ऊष्माक्षेपी प्रक्रिया है। इसलिए, बढ़ते तापमान के साथ गैसों की घुलनशीलता कम हो जाती है। यदि आप एक गिलास छोड़ते हैं ठंडा पानी, फिर इसकी भीतरी दीवारें गैस के बुलबुले से ढकी हुई हैं - यह हवा है जो पानी में घुल गई थी, गर्म होने के कारण इससे निकल गई थी। उबालकर आप उसमें घुली सारी हवा को पानी से निकाल सकते हैं।
हालांकि, कार्बनिक तरल पदार्थों में गैसों का विघटन अक्सर गर्मी के अवशोषण के साथ होता है; ऐसे मामलों में, जैसे-जैसे तापमान बढ़ता है, गैस की घुलनशीलता बढ़ जाती है।
हेनरी का नियम: किसी दिए गए द्रव की मात्रा में स्थिर तापमान पर घुलने वाली गैस का द्रव्यमान गैस के आंशिक दबाव के सीधे आनुपातिक होता है।
हेनरी का नियम समीकरण द्वारा व्यक्त किया जा सकता है
= केपी
जहाँ C संतृप्त विलयन में गैस का द्रव्यमान सांद्रण है; पी आंशिक दबाव है;क एक आनुपातिकता कारक है जिसे हेनरी स्थिरांक (या हेनरी का कारक) कहा जाता है।
हम हेनरी के नियम के एक महत्वपूर्ण परिणाम पर ध्यान देते हैं: एक निश्चित तापमान पर तरल की एक निश्चित मात्रा में घुलने वाली गैस की मात्रा उसके आंशिक दबाव पर निर्भर नहीं करती है।यदि द्रव के ऊपर कई गैसों का मिश्रण है, तो उनमें से प्रत्येक की घुलनशीलता उसके आंशिक दबाव से निर्धारित होती है.
अन्य गैसों के साथ मिश्रित गैसों की घुलनशीलता की गणना करते समय इसे ध्यान में रखा जाना चाहिए। गैसें हेनरी के पाई के नियम का पालन करती हैं, बहुत अधिक दबाव नहीं और, इसके अलावा, केवल उस स्थिति में जब वे विलायक के साथ रासायनिक संपर्क में प्रवेश नहीं करते हैं। उच्च दाब पर, जब सभी गैसों का व्यवहार आदर्श से स्पष्ट रूप से भिन्न होता है, हेनरी के नियम से विचलन उन गैसों के मामले में भी देखे जाते हैं जो रासायनिक रूप से विलायक के साथ परस्पर क्रिया नहीं करते हैं।
अधिकांश पदार्थों की घुलनशीलता घटते तापमान के साथ घट जाती है, इसलिए, जब गर्म संतृप्त घोल को ठंडा किया जाता है, तो आमतौर पर अतिरिक्त विलेय निकलता है। हालाँकि, यदि घोल को बाहर से घुले हुए पदार्थ के कणों के प्रवेश की संभावना से समाधान की रक्षा करते हुए सावधानीपूर्वक और धीरे-धीरे किया जाता है, तो समाधान से इसका अलगाव नहीं हो सकता है। इस मामले में, किसी दिए गए तापमान पर संतृप्ति के लिए आवश्यक से काफी अधिक विलेय युक्त एक समाधान प्राप्त किया जाएगा। इस घटना की खोज और अध्ययन रूसी शिक्षाविद टी.ई. लोविट्स (1794) ने किया था, जिन्होंने इस तरह के समाधानों को सुपरसैचुरेटेड कहा था। शांत अवस्था में, वे वर्षों तक अपरिवर्तित रह सकते हैं। लेकिन किसी को केवल उस पदार्थ के क्रिस्टल को घोल में फेंकना होता है जो उसमें घुल जाता है, जैसे ही अन्य क्रिस्टल उसके चारों ओर बढ़ने लगते हैं और थोड़े समय के बाद घुले हुए पदार्थ की पूरी अतिरिक्त मात्रा क्रिस्टलीकृत हो जाती है। कभी-कभी क्रिस्टलीकरण की शुरुआत विलयन के साधारण झटकों से होती है, साथ ही कांच की छड़ को उस बर्तन की दीवारों पर रगड़ने से भी होता है जिसमें घोल स्थित होता है। क्रिस्टलीकरण के दौरान, गर्मी की एक महत्वपूर्ण मात्रा जारी की जाती है, ताकि समाधान वाला बर्तन ध्यान से गर्म हो जाए। सुपरसैचुरेटेड घोल बहुत आसानी से बनाते हैंना 2 SO 4 -10 H 2 O (ग्लॉबर का नमक),ना 2 बी 4 0 7 - 10 एच 2 ओ (बोरेक्स), ना 2 एस 2 03-5 एच 2 0 (सोडियम थायोसल्फेट)।
यह कहा गया है कि सुपरसैचुरेटेड सॉल्यूशन अस्थिर सिस्टम हैं जो सिस्टम में विलेय सॉलिड की अनुपस्थिति में ही मौजूद रहने में सक्षम हैं। इस तरह के समाधानों के दीर्घकालिक अस्तित्व की संभावना को सबसे छोटे "बीज" क्रिस्टल की प्रारंभिक उपस्थिति की कठिनाई से समझाया गया है, तथाकथित क्रिस्टलीकरण केंद्र, जिससे क्रिस्टलीकरण समाधान के पूरे द्रव्यमान में फैलता है।
समाधान एक सजातीय प्रणाली है। एक विलेय और विलायक के कण एक यादृच्छिक तापीय गति में होते हैं और समान रूप से समाधान के पूरे आयतन में वितरित होते हैं। यदि आप किसी पदार्थ का सांद्र विलयन, उदाहरण के लिए चीनी, को एक सिलेंडर में रखते हैं, और ध्यान से उसके ऊपर एक अधिक पतला चीनी समाधान की एक परत डालते हैं, तो पहले चीनी और पानी की मात्रा में असमान रूप से वितरित किया जाएगा समाधान।
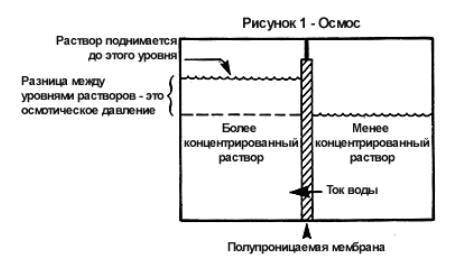 ... हालांकि, थोड़ी देर बाद, चीनी और पानी के अणु फिर से तरल की पूरी मात्रा में समान रूप से वितरित हो जाएंगे। इसका कारण यह है कि चीनी के अणु, बेतरतीब ढंग से चलते हुए, एक केंद्रित घोल से एक पतला और विपरीत दिशा में दोनों में प्रवेश करते हैं; लेकिन साथ ही, किसी भी समयावधि के दौरान, अधिक चीनी अणु अधिक सांद्र विलयन से कम सांद्र विलयन में जाते हैं, न कि तनु विलयन से सांद्रित विलयन में। उसी तरह, पानी के अणु अलग-अलग दिशाओं में चलते हैं, लेकिन पानी के अधिक अणु पानी में समृद्ध, एक केंद्रित समाधान से एक ही समय के दौरान विपरीत दिशा में स्थानांतरित होने की तुलना में अधिक होते हैं। इस प्रकार, चीनी का एक सांद्र विलयन से एक तनु विलयन की ओर एक निर्देशित गति होती है, और पानी - एक तनु विलयन से एक सांद्रित विलयन की ओर; इस मामले में, प्रत्येक पदार्थ को उस स्थान पर स्थानांतरित किया जाता है जहां इसकी एकाग्रता कम होती है। किसी पदार्थ की गति की ऐसी स्वतःस्फूर्त प्रक्रिया, जिससे उसकी सांद्रता समान हो जाती है, विसरण कहलाती है।
... हालांकि, थोड़ी देर बाद, चीनी और पानी के अणु फिर से तरल की पूरी मात्रा में समान रूप से वितरित हो जाएंगे। इसका कारण यह है कि चीनी के अणु, बेतरतीब ढंग से चलते हुए, एक केंद्रित घोल से एक पतला और विपरीत दिशा में दोनों में प्रवेश करते हैं; लेकिन साथ ही, किसी भी समयावधि के दौरान, अधिक चीनी अणु अधिक सांद्र विलयन से कम सांद्र विलयन में जाते हैं, न कि तनु विलयन से सांद्रित विलयन में। उसी तरह, पानी के अणु अलग-अलग दिशाओं में चलते हैं, लेकिन पानी के अधिक अणु पानी में समृद्ध, एक केंद्रित समाधान से एक ही समय के दौरान विपरीत दिशा में स्थानांतरित होने की तुलना में अधिक होते हैं। इस प्रकार, चीनी का एक सांद्र विलयन से एक तनु विलयन की ओर एक निर्देशित गति होती है, और पानी - एक तनु विलयन से एक सांद्रित विलयन की ओर; इस मामले में, प्रत्येक पदार्थ को उस स्थान पर स्थानांतरित किया जाता है जहां इसकी एकाग्रता कम होती है। किसी पदार्थ की गति की ऐसी स्वतःस्फूर्त प्रक्रिया, जिससे उसकी सांद्रता समान हो जाती है, विसरण कहलाती है।
विभिन्न समाधानों के आसमाटिक दबाव को मापते समय, यह पाया गया कि आसमाटिक दबाव का परिमाण घोल की सांद्रता और उसके तापमान पर निर्भर करता है, लेकिन यह विलेय की प्रकृति या विलायक की प्रकृति पर निर्भर नहीं करता है। 1886 में, वैंट हॉफ ने दिखाया कि कम सांद्रता के गैर-इलेक्ट्रोलाइट समाधानों के लिए, समाधान तापमान की एकाग्रता पर आसमाटिक दबाव की निर्भरता समीकरण (वान्ट हॉफ के नियम) द्वारा व्यक्त की जाती है:
पी = सीआरटी
यहाँ P विलयन का परासरणी दाब है, kPa; सी - इसकी दाढ़ एकाग्रता (दाढ़), मोल / एल;आर - सार्वभौमिक गैस स्थिरांक, 8.314 J / (mol-K); T विलयन का परम ताप है।
किसी दिए गए तापमान पर, प्रत्येक तरल के ऊपर संतृप्त वाष्प दाब एक स्थिर मान होता है। अनुभव से पता चलता है कि जब कोई पदार्थ किसी तरल में घुल जाता है, तो इस तरल का संतृप्त वाष्प दाब कम हो जाता है।
इस प्रकार, विलयन पर विलायक के संतृप्त वाष्प का दबाव समान तापमान पर शुद्ध विलायक के दबाव से हमेशा कम होता है। इन मूल्यों के बीच के अंतर को आमतौर पर समाधान पर वाष्प के दबाव में कमी (या समाधान के वाष्प दबाव में कमी) कहा जाता है। शुद्ध विलयन पर संतृप्त वाष्प के दबाव में इस कमी के परिमाण का अनुपात, शरीर को समाधान पर वाष्प के दबाव में सापेक्ष कमी कहा जाता है।
आइए हम p . के माध्यम से शुद्ध विलायक पर विलायक के संतृप्त वाष्प के दबाव को निरूपित करें 0 , और नदी के माध्यम से समाधान के ऊपर। तब विलयन पर वाष्प दाब में आपेक्षिक कमी एक भिन्न होगी: (Po - P) / Po
1887 में, फ्रांसीसी भौतिक विज्ञानी राउल ने ठोस अवस्था में विभिन्न गैर-वाष्पशील तरल पदार्थों और पदार्थों के समाधानों का अध्ययन करते हुए, एकाग्रता के साथ गैर-इलेक्ट्रोलाइट्स के तनु समाधानों पर वाष्प के दबाव में कमी से संबंधित एक कानून स्थापित किया:
घोल के ऊपर विलायक के संतृप्त वाष्प के दबाव में सापेक्ष कमी विलेय के दाढ़ अंश के बराबर होती है।
राउल्ट के नियम की गणितीय अभिव्यक्ति समीकरण है:
(पो - पी) / पो = नी
यहां एन 2 - विलेय का मोलर अंश। किसी विलयन पर संतृप्त वाष्प दाब में कमी की परिघटना ले चेटेलियर के सिद्धांत का अनुसरण करती है।
अलग-अलग पदार्थों को कड़ाई से परिभाषित संक्रमण तापमान द्वारा एकत्रीकरण की एक अवस्था से दूसरे (क्वथनांक, गलनांक, उच्च बनाने की क्रिया तापमान, आदि) की विशेषता होती है। तो पानी, सामान्य वायुमंडलीय दबाव (101.3 kPa) पर 0 ° C पर क्रिस्टलीकृत होता है और 100 ° C पर उबलता है।
समाधान के साथ स्थिति अलग है। एक विलेय की उपस्थिति क्वथनांक को बढ़ाती है और विलायक के हिमांक को कम करती है, और घोल जितना अधिक गाढ़ा होता है। ज्यादातर मामलों में, केवल विलायक समाधान (ठंड के दौरान) से समाधान से क्रिस्टलीकृत होता है या उबलता है (उबलते समय), जिसके परिणामस्वरूप समाधान की एकाग्रता इसके जमने या उबालने के दौरान बढ़ जाती है। यह, बदले में, क्वथनांक में और भी अधिक वृद्धि और क्रिस्टलीकरण तापमान में कमी की ओर जाता है। इस प्रकार, समाधान एक निश्चित तापमान पर नहीं, बल्कि एक निश्चित तापमान सीमा में क्रिस्टलीकृत और उबलता है। क्रिस्टलीकरण की शुरुआत का तापमान और किसी दिए गए घोल के उबलने की शुरुआत को इसका क्रिस्टलीकरण तापमान और क्वथनांक कहा जाता है।
विलयन के क्वथनांक के बीच का अंतर (t .)प्रति ) और शुद्ध विलायक (t .)ठीक है ) को विलयन के क्वथनांक में वृद्धि कहा जाता है (tप्रति ) शुद्ध विलायक के हिमांक के बीच का अंतर (t .)) समाधान (टी З ) विलयन के हिमांक में कमी (Δt .) कहलाता हैएच)।
t से = t से - t ठीक; t = टी ОЗ - टी ।
कोई भी तरल उस तापमान पर उबलने लगता है जिस पर उसके संतृप्त वाष्प का दबाव बाहरी दबाव के मूल्य तक पहुँच जाता है। उदाहरण के लिए, १०१.३ kPa के दबाव में पानी १०० ° C पर उबलता है क्योंकि इस तापमान पर जल वाष्प का दबाव ठीक १०१.३ kPa है। यदि आप किसी अवाष्पशील पदार्थ को जल में घोलेंगे तो वाष्प दाब कम हो जाएगा। परिणामी घोल के वाष्प दबाव को 101.3 kPa तक लाने के लिए, घोल को 100 ° C से ऊपर गर्म करना आवश्यक है। अतः यह निष्कर्ष निकलता है कि विलयन का क्वथनांक हमेशा शुद्ध विलायक के क्वथनांक से अधिक होता है। समाधान के हिमांक को कम करने की व्याख्या इसी तरह से की गई है।
क्वथनांक को बढ़ाना और विलयन के हिमांक को कम करना ले चेटेलियर के सिद्धांत के अनुरूप है। किसी विलयन को जमने की प्रक्रिया पर विचार करें। तरल और ठोस चरण के बीच एक संतुलन होने दें, उदाहरण के लिए, 0 ° पर पानी-बर्फ संतुलन। इसे समीकरण द्वारा व्यक्त किया जा सकता है:
एच 2 ओ (के) एच + + ओएच -
यदि आप किसी पदार्थ की एक निश्चित मात्रा को पानी में घोलते हैं, तो तरल में पानी के अणुओं की सांद्रता कम हो जाएगी और इसे बढ़ाने की एक प्रक्रिया शुरू हो जाएगी - बर्फ का पिघलना। एक नया संतुलन स्थापित करने के लिए, तापमान को कम करना आवश्यक है।
राउल्ट के दूसरे नियम के अनुसार: गैर-इलेक्ट्रोलाइट्स के तनु विलयनों के लिए, क्वथनांक में वृद्धि और हिमांक में कमी घोल की सांद्रता के समानुपाती होती है।
Δटी के = ई · सी एम (बी); = · मीटर (В)।
यहाँ एम (बी) - मोलल एकाग्रता; ई और के - एबुलियोस्कोपिक और क्रायोस्कोपिक स्थिरांक, केवल विलायक की प्रकृति पर निर्भर करता है, लेकिन विलेय की प्रकृति पर निर्भर नहीं करता है। पानी के लिए, क्रायोस्कोपिक स्थिरांक K 1.86 है, एबुलियोस्कोपिक स्थिरांक E 0.52 है। निर्धारण के एबुलियोस्कोपिक और क्रायोस्कोपिक तरीके समाधान के उबलते और ठंड के तापमान के माप पर आधारित हैं। आणविक भारपदार्थ।
प्रतिरोधी विलयन- समाधान, हाइड्रोजन आयनों (पीएच) की एकाग्रता जो एक मजबूत एसिड या क्षार (पीएच देखें) की सीमित मात्रा में जोड़ने से नहीं बदलती है। NS। एक कमजोर एसिड के घोल और एक मजबूत आधार के नमक या इसके विपरीत, एक कमजोर आधार और एक मजबूत एसिड के नमक के मिश्रण से मिलकर बनता है, उदाहरण के लिए: सीएच 3 सीओओएच + सीएच 3 OONa - एसीटेट बफर, NH 4 OH + NHCl - अमोनिया बफर। कभी-कभी बी.आर. एक पॉलीबेसिक कमजोर एसिड और एक मजबूत आधार के दो अम्लीय या अम्लीय और बुनियादी नमक के समाधान के मिश्रण के रूप में काम कर सकता है। उदाहरण के लिए, फॉस्फेट बी.पी. निम्नलिखित युग्मों से बनाया जा सकता है: १) एच 3 पीओ 4 + नाह 2 पीओ 4; 2) नाह २ पीओ ४ + ना २ एचपीओ ४; 3) ना २ एचपीओ ४ + ना ३ पीओ ४ , और कार्बोनेट - १ से) एच 2 सीओ 3 + नाहको 3; २) नाहको ३ + ना २ सीओ ३ ... बी. की कार्रवाई। दो परस्पर संतुलन प्रणालियों की उपस्थिति से निर्धारित होता है - पृथक्करण और हाइड्रोलिसिस। कार्रवाई की सीमा निर्धारित करने के लिए बी. पी. बफर क्षमता की अवधारणा पेश की गई है, जिसे एक मजबूत एसिड या बेस (जी-ईक्यू में) की मात्रा से मापा जाता है, जिसे पीएच को एक से स्थानांतरित करने के लिए 1 लीटर बीआर में जोड़ा जाना चाहिए। अधिकतम बफर क्षमता समान मात्रा में घटकों की सामग्री से मेल खाती है। कम खनिज में प्राकृतिक जलआह बफरिंग मुख्य रूप से कार्बोनेट्स द्वारा बनाई जाती है, अर्थात। मुक्त कार्बोनिक एसिड और मजबूत आधारों के इसके लवण (Ca, Mg, Na)। समुद्री जल में बोरेट बफर बफरिंग क्षमता के निर्माण में भी भाग लेता है। समुद्र के पानी की बफर क्षमता 0हे सी 35 . की एकाग्रता के साथ NaCl समाधान की तुलना में 11 गुना अधिक हैओओओ और आसुत जल से 9 गुना अधिक है। 30 . परहे आधिक्य क्रमशः 25 और 19 गुना है। तापमान के साथ समुद्री जल की बफर क्षमता में इस तरह की वृद्धि बफरिंग क्षमता बनाने वाले घटकों के बढ़े हुए पृथक्करण और हाइड्रोलिसिस से जुड़ी है। सीओ की बेहतर घुलनशीलता के कारण आसुत जल में NaCl समाधान की तुलना में थोड़ी अधिक बफरिंग क्षमता होती है 2 ... चूंकि पीएच मान घटकों की सांद्रता पर निर्भर नहीं करता है, बल्कि उनके अनुपात पर निर्भर करता है, फिर जब बी.पी. यह स्थिर रहता है। उसी समय, प्राकृतिक जल की उच्च बफर क्षमता के बावजूद, प्रकाश संश्लेषण (देखें) या श्वसन की प्रक्रियाएं पीएच मान को दृढ़ता से प्रभावित करती हैं, क्योंकि सीओ सांद्रता के बीच का अनुपात बदल जाता है। 2 और एचसीओ 3 - ... NS। जीवों में महत्वपूर्ण भूमिका निभाते हैं। यह जोड़ा जा सकता है कि उच्च जानवरों और मनुष्यों के विभिन्न अंगों में कड़ाई से निश्चित पीएच मान, एक नियम के रूप में, एक द्वारा नहीं, बल्कि जैविक प्रक्रियाओं की एक पूरी प्रणाली द्वारा बनाए रखा जाता है, उदाहरण के लिए, रक्त में - आधारित बफर समाधान द्वारा कार्बोनेट और फॉस्फेट पर। जलाशय में प्रवेश करने वाले अम्लीय या क्षारीय अपशिष्ट जल को प्राकृतिक जल के कार्बोनेट बफर सिस्टम द्वारा निष्प्रभावी किया जा सकता है। यह जल उपचार के दौरान अभिकर्मकों को जोड़ते समय जल पीएच की स्थिरता बनाए रखने में भी योगदान देता है। जैविक अपशिष्ट जल उपचार (देखें) के साथ, सूक्ष्मजीवों की महत्वपूर्ण प्रक्रियाओं के सामान्य पाठ्यक्रम के लिए इष्टतम पीएच मान बफर सिस्टम (कार्बोनेट, अमोनियम और फॉस्फेट सिस्टम) की उपस्थिति द्वारा समर्थित हैं। इसके अलावा, बी.आर. पानी के रासायनिक विश्लेषण में व्यापक रूप से उपयोग किया जाता है।
जल और समाधान पृष्ठ 8
जलीय समाधानों में अकार्बनिक पदार्थों के कम-केंद्रित संतृप्त समाधान, साथ ही सुगंधित जल शामिल होते हैं जिनमें अल्कोहल नहीं होता है।
बुरोव का द्रव। यह 7.6-9.2% की सांद्रता और 1.044-1.048 के घनत्व के साथ मूल एल्यूमीनियम एसीटेट का एक जलीय घोल है। इससे पहले, बुरोव का तरल एसिटिक एसिड में इसके बाद के विघटन के साथ एल्यूमिना हाइड्रेट के गठन की प्रतिक्रिया से प्राप्त किया गया था। में पिछले सालयह ए.आई. कोनोवालोवा द्वारा विकसित इलेक्ट्रोलिसिस विधि द्वारा निर्मित है। यह धातु एल्यूमीनियम के 8% एसिटिक एसिड के घोल में से गुजरते समय एनोडिक विघटन की प्रक्रिया पर आधारित है। विद्युत प्रवाह... नतीजतन, बुनियादी एल्यूमीनियम एसीटेट के गठन की प्रतिक्रिया आगे बढ़ती है।
बेसिक लेड एसीटेट घोल। सीसा सिरका। यह 16.7-17.4% की धात्विक सीसा सामग्री और 1.225-1.230 के घनत्व के साथ मूल लेड एसीटेट का एक जलीय घोल है। हवा में खड़े होने पर, हवा से कार्बन डाइऑक्साइड के तीव्र अवशोषण के कारण घोल बादल बन जाता है। गर्म होने पर लेड एसीटेट और लेड ऑक्साइड की परस्पर क्रिया द्वारा दवा प्राप्त की जाती है। 3. पी. बेरिद्ज़े ने लेड ऑक्साइड और एसिटिक एसिड से बेसिक लेड एसीटेट का घोल प्राप्त करने का प्रस्ताव रखा।
अपने आप में, एक मूल लेड एसीटेट समाधान का उपयोग नहीं किया जाता है। फार्मेसियों में इससे लेड लोशन तैयार किया जाता है: बेसिक लेड एसीटेट के 2 भाग और पानी के 98 भाग। लेड लोशन, बुरोव के तरल पदार्थ की तरह, एक कसैले और विरोधी भड़काऊ एजेंट है।
नीबू का रास। हाइड्रॉक्साइडेशन समाधान। चूने का पानी कैल्शियम हाइड्रॉक्साइड का एक संतृप्त जलीय घोल है जिसकी सांद्रता 0.15-0.17% है। जले हुए चूने (कैल्शियम ऑक्साइड) को बुझाने की प्रतिक्रिया से प्राप्त होता है, इसके बाद ठंड में कैल्शियम हाइड्रॉक्साइड घोल की संतृप्ति होती है। तैयार उत्पाद एक स्पष्ट, रंगहीन तरल है जिसमें जोरदार क्षारीय प्रतिक्रिया होती है। यह गैस्ट्रिक जूस और दस्त की बढ़ी हुई अम्लता के साथ बाल चिकित्सा अभ्यास में दूध के साथ मौखिक रूप से मिश्रित होता है।
पोटेशियम आर्सेनाइट घोल। फाउलर का आर्सेनिक घोल। एक आधिकारिक समाधान, जो पोटेशियम कार्बोनेट के साथ मिश्रित आर्सेनस एनहाइड्राइड (जो तैयारी में 0.97-1.03% होना चाहिए) का एक जलीय घोल है।
पोटेशियम आर्सेनाइट का घोल प्राप्त करने के लिए, पोटेशियम कार्बोनेट के 10 भागों को उबलते पानी के 10 भागों में घोल दिया जाता है, आर्सेनस एनहाइड्राइड के 10 भागों को मिलाया जाता है और तरल को उबलने तक (पूर्ण विघटन तक) गर्म किया जाता है। इसके बाद, समाधान 500 ग्राम पानी से पतला होता है और पतला हाइड्रोक्लोरिक एसिड धीरे-धीरे हलचल के साथ जोड़ा जाता है जब तक कि समाधान तटस्थ न हो, जो अन्य आर्सेनिक नमक के गठन को रोकने के लिए आवश्यक है। न्यूट्रलाइज़ेशन के बाद, 90 भाग अल्कोहल (मात्रा के अनुसार) और 10 भाग कपूर अल्कोहल (मात्रा के अनुसार) घोल में मिलाया जाता है। पोटेशियम आर्सेनाइट का एक घोल एक सूची ए दवा है। त्वरित और आसान ऑर्गेनोलेप्टिक पहचान के उद्देश्य से इसमें कपूर अल्कोहल मिलाया जाता है।
तैयारी को ताला और चाबी (कैबिनेट ए) के नीचे अच्छी तरह से सील अंधेरे कांच की शीशियों में स्टोर करें। यह एनीमिया, न्यूरस्थेनिया, थकावट और पुरानी ल्यूकेमिया के लिए निर्धारित है।
सुगंधित जल। वे पानी में आवश्यक तेलों के कमजोर रूप से केंद्रित समाधान हैं। ये विलेय गंध के साथ स्पष्ट या थोड़े ओपेलेसेंट तरल होते हैं। दुर्लभ अपवादों (सोआ और कड़वा बादाम पानी) के साथ, उनके पास एक स्वतंत्र औषधीय उद्देश्य नहीं है और उन्हें सुधारात्मक एजेंटों (गंध को ठीक करने के लिए) के रूप में उपयोग किया जाता है।
उत्पादन की विधि के आधार पर, सरल और आसुत सुगंधित जल के बीच अंतर किया जाता है।
साधारण सुगन्धित जल तत्त्वों के प्रत्यक्ष विलयन से प्राप्त होते हैं आवश्यक तेलपानी में 1: 1000 के अनुपात में (गुलाब के पानी को छोड़कर, जो गुलाब के तेल की तेज गंध के कारण 1: 4000 के अनुपात में तैयार किया जाता है)। घुलने से पहले, आवश्यक तेल को तालक के साथ ट्रिट्यूरेट किया जाता है और गर्म (60 ° तक) पानी में घोल दिया जाता है। विघटन प्रक्रिया में सुधार के लिए दोनों ऑपरेशन आवश्यक हैं। घोल में अतिरिक्त तेल को गीले फिल्टर से छान लिया जाता है।
सरल सुगंधित पानी की स्थिरता को बढ़ाने के लिए, उनमें सर्फेक्टेंट जोड़ने की सिफारिश की जाती है जो सॉल्यूबिलाइज़र की भूमिका निभाते हैं: ट्वीन्स, स्पेंस, एथिल स्टीयरेट और अन्य पदार्थ जो घुलनशीलता में सुधार करते हैं।
आसुत सुगंधित जल आसवन द्वारा तैयार किया जाता है, जिसमें आवश्यक तेल कच्चे माल के माध्यम से "गर्म" जल वाष्प पारित होता है। जल वाष्प के साथ आसवन की प्रक्रिया डाल्टन के नियम पर आधारित है, जिसके अनुसार दो अमिश्रणीय तरल पदार्थ प्रत्येक अलग से कम तापमान पर आसुत होते हैं, क्योंकि ऐसे मिश्रण के वाष्प का निर्माण तब होता है जब मिश्रण घटकों के आंशिक दबावों का योग वायुमंडलीय दबाव बराबर है।
सुगंधित पानी प्राप्त करने के लिए, आवश्यक तेल कच्चे माल को आसवन घन में रखा जाता है, जिसके माध्यम से जल वाष्प पारित होता है, इसके साथ आवश्यक तेल को कंडेनसर में प्रवेश करता है। ठंडे पानी से ठंडा किए गए कंडेनसर में, पानी और आवश्यक तेल वाष्प संघनित होते हैं और तैयार सुगंधित पानी के रूप में रिसीवर में प्रवाहित होते हैं। यदि आसवन के दौरान अतिरिक्त आवश्यक तेल बनता है जो पानी में नहीं घुलता है, तो इसे अलग-अलग रिसीवर में डाला जाता है।
औषधीय अभ्यास में आसुत सुगंधित जल से, कड़वा-बादाम पानी और डिल पानी कमोबेश व्यापक रूप से उपयोग किया जाता है, आंतों के कार्यों में सुधार के लिए आंतरिक रूप से उपयोग किया जाता है।
अल्कोहल से सुगंधित पानी भी तैयार किया जाता है। ऐसे में उनमें एसेंशियल ऑयल की सांद्रता बढ़ाई जा सकती है।
जलीय समाधानों में अकार्बनिक पदार्थों के कम-केंद्रित संतृप्त समाधान, साथ ही सुगंधित जल शामिल होते हैं जिनमें अल्कोहल नहीं होता है।
खोदने वाला द्रव(शराब बुरोवी, सोलुटियो एलुमिनी सबसेटेटिस)। यह 7.6-9.2% की सांद्रता और 1.044-1.048 के घनत्व (σ 20) के साथ मूल एल्यूमीनियम एसीटेट का एक जलीय घोल है। इससे पहले, बुरोव का तरल एसिटिक एसिड में इसके बाद के विघटन के साथ एल्यूमिना हाइड्रेट के गठन की प्रतिक्रिया से प्राप्त किया गया था। हाल के वर्षों में, एआई कोनोवालोवा द्वारा 1951 में विकसित इलेक्ट्रोलिसिस विधि द्वारा बुरोव के तरल का उत्पादन किया गया है। यह विधि धात्विक एल्युमिनियम के 8% एसिटिक अम्ल के विलयन में विद्युत धारा प्रवाहित करके इसके एनोडिक विघटन की प्रक्रिया पर आधारित है (चित्र 52)। नतीजतन, बुनियादी एल्यूमीनियम एसीटेट के गठन की प्रतिक्रिया आगे बढ़ती है, जिसमें सामान्य रूप से देखेंनिम्नानुसार व्यक्त किया जा सकता है:
2ए एल + 2एच 2 ओ + 4सीएच 3 सीओओएच → 3 एच 2 + 2एएल (ओएच) (सीएच 3 सीओओ) 2
बेसिक लेड एसीटेट घोल। सीसा सिरका(सॉल्यूटियो प्लंबी सबसेटेटिस)। यह 16.7-17.4% की धात्विक सीसा सामग्री और 1.225-1.230 के घनत्व के साथ मूल लेड एसीटेट का एक जलीय घोल है। हवा में खड़े होने पर, हवा से कार्बन डाइऑक्साइड के तीव्र अवशोषण के कारण घोल बादल बन जाता है। गर्म होने पर लेड एसीटेट और लेड ऑक्साइड की परस्पर क्रिया द्वारा दवा प्राप्त की जाती है।
अपने आप में, एक मूल लेड एसीटेट समाधान का उपयोग नहीं किया जाता है। नुस्खा के अनुसार फार्मेसियों में इससे एक लेड लोशन (एक्वा प्लंबी) तैयार किया जाता है: बेसिक लेड एसीटेट के घोल के 2 भाग और पानी के 98 भाग। लेड लोशन, बुरोव के तरल पदार्थ की तरह, एक कसैले और विरोधी भड़काऊ एजेंट है।
नीबू का रास। कैल्शियम हाइड्रॉक्साइड घोल(एक्वा कैल्सिस। कैल्शियम हाइड्रॉक्साइडम सोल्यूटम)। चूने का पानी कैल्शियम हाइड्रॉक्साइड का एक संतृप्त जलीय घोल है जिसकी सांद्रता 0.15-0.17% है। जले हुए चूने (कैल्शियम ऑक्साइड) को बुझाने की प्रतिक्रिया से प्राप्त होता है, इसके बाद ठंड में कैल्शियम हाइड्रॉक्साइड घोल की संतृप्ति होती है। इस उद्देश्य के लिए, ताजे उबले हुए आसुत जल के 70 भागों में कैल्शियम ऑक्साइड का 1 भाग लें। सबसे पहले, कैल्शियम हाइड्रॉक्साइड प्राप्त करने के लिए पाउडर को इसकी थोड़ी मात्रा (लगभग 1/3) के साथ डाला जाता है, और फिर शेष पानी को एक संतृप्त जलीय घोल प्राप्त होने तक कैल्शियम हाइड्रॉक्साइड के एक भावपूर्ण द्रव्यमान पर जोर दिया जाता है। तैयार उत्पाद एक स्पष्ट, रंगहीन तरल है जिसमें जोरदार क्षारीय प्रतिक्रिया होती है। यह गैस्ट्रिक जूस और दस्त की बढ़ी हुई अम्लता के साथ बच्चों के अभ्यास में दूध के साथ मौखिक रूप से प्रयोग किया जाता है।
पोटेशियम आर्सेनाइट घोल। फाउलर आर्सेनिक समाधान(शराब काली आर्सेनाइटिस। शराब आर्सेनिकलिस फाउलेरी)। आधिकारिक समाधान (GFH, लेख संख्या 378), जो पोटेशियम कार्बोनेट के साथ मिश्रित आर्सेनस एनहाइड्राइड (जो तैयारी में 0.97-1.03% होना चाहिए) का एक जलीय घोल है। दवा निर्माण की प्रतिक्रिया इस प्रकार है:
जैसा 2 ओ 3 + के 2 सीओ 3 1.5 एच 2 ओ → 2 केए ओ 2 + सीओ 2 + 1.5 एच 2 ओ।
पोटेशियम आर्सेनाइट का घोल प्राप्त करने के लिए, पोटेशियम कार्बोनेट के 10 भागों को उबलते पानी के 10 भागों में घोल दिया जाता है, आर्सेनस एनहाइड्राइड के 10 भागों को मिलाया जाता है और तरल को उबलने तक (पूर्ण विघटन तक) गर्म किया जाता है। इसके बाद, समाधान 500 ग्राम पानी से पतला होता है और पतला हाइड्रोक्लोरिक एसिड धीरे-धीरे हलचल के साथ जोड़ा जाता है जब तक कि समाधान तटस्थ न हो, जो अन्य आर्सेनिक नमक के गठन को रोकने के लिए आवश्यक है। न्यूट्रलाइज़ेशन के बाद, 90 भाग अल्कोहल (मात्रा के अनुसार) और 10 भाग कपूर अल्कोहल (मात्रा के अनुसार) घोल में मिलाया जाता है। पोटेशियम आर्सेनाइट का एक घोल सूची ए की तैयारी है। त्वरित और आसान ऑर्गेनोलेप्टिक पहचान के उद्देश्य से इसमें कपूर सी पाई मिलाया जाता है।
तैयारी को अच्छी तरह से सील अंधेरे कांच की शीशियों में ताला और चाबी (कैबिनेट ए) के नीचे स्टोर करें। यह एनीमिया, न्यूरस्थेनिया, थकावट और पुरानी ल्यूकेमिया के लिए निर्धारित है।
धातु विषाक्तता के लिए मारक(एंटीडोटम मेटलोरम)। भारी धातुओं के साथ विषाक्तता के लिए एक एंटीडोट के रूप में, संरचना के एक समाधान का उपयोग किया जाता है: मैग्नीशियम सल्फेट क्रिस्टलीय - 3.75 भाग, सोडियम हाइड्रोकार्बन - 12.5 भाग, कास्टिक सोडा (100% के संदर्भ में) - 1 भाग, हाइड्रोजन सल्फाइड - आवश्यकतानुसार, पानी - 1000 भाग। समाधान तैयार करने की तकनीक इस प्रकार है: 0.2% सोडियम हाइड्रॉक्साइड घोल के 500 भाग गैसीय हाइड्रोजन सल्फाइड से संतृप्त होते हैं, जो पहले पानी में कैल्शियम कार्बोनेट के निलंबन के माध्यम से बुदबुदाते हुए पारित होते थे। पानी के अन्य 500 भागों में (ताजा तैयार और 50 डिग्री सेल्सियस तक ठंडा) सोडियम बाइकार्बोनेट और मैग्नीशियम सल्फेट को भंग कर दिया जाता है। घोल को ठंडा किया जाता है, पहले घोल के साथ मिलाया जाता है, संयुक्त घोल को शून्य से 2-3 ° C तक ठंडा किया जाता है और फिर से हाइड्रोजन सल्फाइड से संतृप्त किया जाता है जब तक कि इसकी सांद्रता 0.4% तक न पहुँच जाए, जिसके बाद घोल उपयोग के लिए तैयार हो जाता है। तैयार उत्पाद एक नींबू-पीला घोल है जिसमें थोड़ा हरा रंग, हाइड्रोजन सल्फाइड की तीखी गंध और एक कसैला, नमकीन-कड़वा स्वाद होता है।
समाधान में SO 4 2- और S 2- आयन, भारी धातुओं के साथ बातचीत करते हुए, उन्हें शरीर में अघुलनशील, गैर-अवशोषित यौगिकों में परिवर्तित करते हैं, जिस पर दवा की क्रिया एक मारक के रूप में आधारित होती है।
सुगंधित पानी(एक्वा एरोमेटिके)। वे पानी में आवश्यक तेलों के कमजोर रूप से केंद्रित समाधान हैं। ये एक विलेय गंध के साथ स्पष्ट या थोड़े ओस वाले तरल पदार्थ होते हैं। दुर्लभ अपवादों (सोआ और कड़वा बादाम पानी) के साथ, उनके पास एक स्वतंत्र औषधीय उद्देश्य नहीं है और उन्हें सुधारात्मक एजेंटों (गंध को ठीक करने के लिए) के रूप में उपयोग किया जाता है।
उत्पादन की विधि के आधार पर, सरल और आसुत सुगंधित जल के बीच अंतर किया जाता है।
साधारण सुगंधित जल 1: 1000 के अनुपात में पानी में संबंधित आवश्यक तेल के प्रत्यक्ष विघटन द्वारा प्राप्त किया जाता है (गुलाब के पानी के अपवाद के साथ, जो गुलाब के तेल की तेज गंध के कारण 1: 4000 के अनुपात में तैयार किया जाता है)। घुलने से पहले, आवश्यक तेल को तालक के साथ ट्रिट्यूरेट किया जाता है (फैलाया जाता है) और गर्म (60 डिग्री सेल्सियस तक) पानी में घोल दिया जाता है। विघटन प्रक्रिया में सुधार के लिए दोनों ऑपरेशन आवश्यक हैं। घोल में अतिरिक्त तेल को गीले फिल्टर से छान लिया जाता है।
सरल सुगंधित पानी की स्थिरता को बढ़ाने के लिए, उनमें सर्फेक्टेंट जोड़ने की सिफारिश की जाती है जो सॉल्यूबिलाइज़र की भूमिका निभाते हैं: ट्वीन्स, स्पेंस, एथिल स्टीयरेट और अन्य पदार्थ जो घुलनशीलता में सुधार करते हैं।
आसुत सुगंधित जल आसवन द्वारा तैयार किया जाता है, जिसमें आवश्यक तेल कच्चे माल के माध्यम से "गर्म" जल वाष्प पारित होता है। जल वाष्प के साथ आसवन की प्रक्रिया डाल्टन के नियम पर आधारित है, जिसके अनुसार दो अमिश्रणीय तरल पदार्थ प्रत्येक अलग से कम तापमान पर आसुत होते हैं, क्योंकि ऐसे मिश्रण के वाष्प का निर्माण तब होता है जब मिश्रण घटकों के आंशिक दबावों का योग वायुमंडलीय दबाव बराबर है।
सुगंधित पानी प्राप्त करने के लिए, आवश्यक तेल कच्चे माल को आसवन घन में रखा जाता है, जिसके माध्यम से जल वाष्प पारित किया जाता है, इसके साथ आवश्यक तेल को कंडेनसर (छवि 53) में प्रवेश करता है।
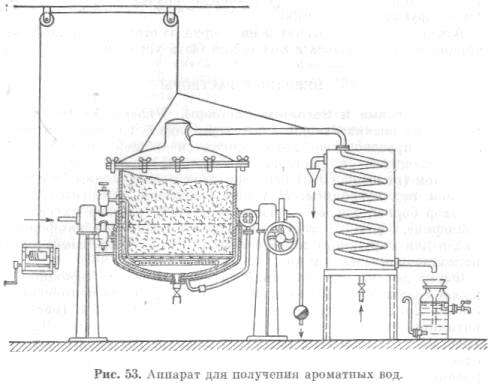
ठंडे पानी से ठंडा किए गए कंडेनसर में, पानी और आवश्यक तेल वाष्प संघनित होते हैं और तैयार सुगंधित पानी के रूप में रिसीवर में प्रवाहित होते हैं। यदि आसवन के दौरान अतिरिक्त आवश्यक तेल बनता है जो पानी में नहीं घुलता है, तो इसे अलग-अलग रिसीवर में डाला जाता है।
फार्मास्युटिकल अभ्यास में आसुत सुगंधित जल से, आंतों के कार्यों में सुधार के लिए आंतरिक रूप से उपयोग किए जाने वाले कड़वा बादाम पानी (एक्वा एमिग्डालारम अमाररम) और डिल वॉटर (एक्वा फोनीकुली) कमोबेश व्यापक रूप से उपयोग किए जाते हैं।
अल्कोहल से सुगंधित पानी भी तैयार किया जाता है। ऐसे में उनमें एसेंशियल ऑयल की सांद्रता बढ़ाई जा सकती है।
१३.१. पानी में पदार्थों की घुलनशीलता
एक समाधान एक सजातीय प्रणाली है जिसमें दो या दो से अधिक पदार्थ होते हैं, जिनमें से सामग्री को एकरूपता को परेशान किए बिना कुछ सीमाओं के भीतर बदला जा सकता है।
जलीयसमाधान से मिलकर बनता है पानी(विलायक) और विलेयएक जलीय घोल में पदार्थों की स्थिति, यदि आवश्यक हो, एक सबस्क्रिप्ट (पी) द्वारा इंगित की जाती है, उदाहरण के लिए, समाधान में केएनओ 3 - केएनओ 3 (पी)।
ऐसे विलयन जिनमें विलेय की थोड़ी मात्रा होती है, प्राय: कहलाते हैं पतलाऔर उच्च विलेय सामग्री वाले समाधान - केंद्रित।वह विलयन जिसमें पदार्थ का और अधिक विलयन संभव हो, कहलाता है असंतृप्तऔर वह समाधान जिसमें दी गई शर्तों के तहत पदार्थ घुलना बंद कर देता है संतृप्तबाद वाला समाधान हमेशा एक अघुलनशील पदार्थ (एक या अधिक क्रिस्टल) के संपर्क में (विषम संतुलन में) होता है।
विशेष परिस्थितियों में, उदाहरण के लिए, जब एक गर्म असंतृप्त विलयन को धीरे से (बिना हिलाए) ठंडा किया जाता है ठोसपदार्थ बन सकते हैं oversaturatedसमाधान। जब किसी पदार्थ का क्रिस्टल पेश किया जाता है, तो इस तरह के घोल को एक संतृप्त घोल और पदार्थ के एक अवक्षेप में अलग किया जाता है।
के अनुसार समाधान का रासायनिक सिद्धांतडी.आई. मेंडलीफ के अनुसार, किसी पदार्थ का जल में घुलना सबसे पहले होता है, विनाशअणुओं के बीच रासायनिक बंधन (सहसंयोजक पदार्थों में अंतर-आणविक बंधन) या आयनों के बीच (आयनिक पदार्थों में), और, इस प्रकार, पदार्थ के कण पानी के साथ मिश्रित होते हैं (जिसमें अणुओं के बीच हाइड्रोजन बंधन का हिस्सा भी नष्ट हो जाता है)। रासायनिक बंधों का टूटना पानी के अणुओं की गति की तापीय ऊर्जा के कारण होता है, जबकि व्ययऊष्मा के रूप में ऊर्जा।
दूसरे, एक बार पानी में, पदार्थ के कण (अणु या आयन) के संपर्क में आते हैं जलयोजन।नतीजतन, हाइड्रेट- पदार्थ के कणों और पानी के अणुओं के बीच अनिश्चित संरचना के यौगिक ( आंतरिक संरचनाकण स्वयं विघटन पर नहीं बदलते हैं)। इस प्रक्रिया के साथ है हाइलाइटिंगहाइड्रेट्स में नए रासायनिक बंधों के बनने के कारण ऊष्मा के रूप में ऊर्जा।
सामान्य तौर पर, समाधान या तो है कूल्स(यदि गर्मी की खपत इसकी रिहाई से अधिक है), या गर्म हो जाती है (अन्यथा); कभी-कभी - यदि गर्मी की खपत और इसकी रिहाई समान होती है - समाधान का तापमान अपरिवर्तित रहता है।
कई हाइड्रेट इतने स्थिर होते हैं कि घोल के पूरी तरह से वाष्पित होने पर भी नष्ट नहीं होते हैं। इस प्रकार, CuSO 4 5H 2 O, Na 2 CO 3 10H 2 O, KAl (SO 4) 2 12H 2 O, आदि लवणों के ठोस क्रिस्टलीय हाइड्रेट ज्ञात हैं।
संतृप्त घोल में पदार्थ की सामग्री content टी= स्थिरांक मात्रात्मक रूप से विशेषताएँ घुलनशीलताइस पदार्थ का। आमतौर पर, घुलनशीलता प्रति 100 ग्राम पानी में विलेय के द्रव्यमान द्वारा व्यक्त की जाती है, उदाहरण के लिए 65.2 ग्राम केबीआर / 100 ग्राम एच 2 ओ 20 डिग्री सेल्सियस पर। इसलिए, यदि ७० ग्राम ठोस पोटेशियम ब्रोमाइड को २० डिग्री सेल्सियस पर १०० ग्राम पानी में पेश किया जाता है, तो ६५.२ ग्राम नमक घोल में चला जाएगा (जो संतृप्त हो जाएगा), और ४.८ ग्राम ठोस केबीआर (अतिरिक्त) पर रहेगा। कांच के नीचे।
यह याद रखना चाहिए कि में विलेय की सामग्री तर-बतरसमाधान बराबरी, में असंतृप्तसमाधान कमऔर में oversaturatedसमाधान अधिककिसी दिए गए तापमान पर इसकी घुलनशीलता। तो, एक सामग्री के साथ 100 ग्राम पानी और सोडियम सल्फेट Na 2 SO 4 (घुलनशीलता 19.2 g / 100 g H 2 O) से 20 ° C पर तैयार घोल
15.7 ग्राम नमक - असंतृप्त;
19.2 ग्राम नमक - संतृप्त;
2O. 3 ग्राम नमक - ओवरसैचुरेटेड।
ठोस पदार्थों की घुलनशीलता (तालिका 14) आमतौर पर बढ़ते तापमान (KBr, NaCl) के साथ बढ़ जाती है, और केवल कुछ पदार्थों (CaSO 4, Li 2 CO 3) के लिए विपरीत देखा जाता है।
बढ़ते तापमान के साथ गैसों की घुलनशीलता कम हो जाती है, और बढ़ते दबाव के साथ बढ़ती है; उदाहरण के लिए, 1 एटीएम के दबाव में, अमोनिया की घुलनशीलता 52.6 (20 डिग्री सेल्सियस) और 15.4 ग्राम / 100 ग्राम एच 2 ओ (80 डिग्री सेल्सियस) है, और 20 डिग्री सेल्सियस और 9 एटीएम पर यह 93.5 ग्राम / 100 है। जी एच 2 ओ।
घुलनशीलता के मूल्यों के अनुसार, पदार्थों को प्रतिष्ठित किया जाता है:
– अच्छी तरह से घुलनशीलजिसका संतृप्त घोल में द्रव्यमान पानी के द्रव्यमान के बराबर होता है (उदाहरण के लिए, केबीआर - 20 डिग्री सेल्सियस पर घुलनशीलता 65.2 ग्राम / 100 ग्राम एच 2 ओ; 4.6 एम समाधान), वे 0.1 से अधिक की दाढ़ के साथ संतृप्त समाधान बनाते हैं। एम;
– अल्प घुलनशीलजिसका संतृप्त घोल में द्रव्यमान पानी के द्रव्यमान से बहुत कम होता है (उदाहरण के लिए, CaSO 4 - 20 ° C पर घुलनशीलता 0.206 g / 100 g H 2 O; 0.015 M घोल) होती है, वे संतृप्त घोल बनाते हैं 0.1-0.001 एम;
– व्यावहारिक रूप से अघुलनशीलजिसका संतृप्त घोल में द्रव्यमान विलायक के द्रव्यमान की तुलना में नगण्य है (उदाहरण के लिए, AgCl - 20 ° C पर घुलनशीलता 0.00019 g प्रति 100 g H2O; 0.0000134M घोल) है, वे कम की दाढ़ के साथ संतृप्त घोल बनाते हैं। 0.001M से अधिक।
संकलित संदर्भ डेटा के आधार पर घुलनशीलता तालिकासामान्य अम्ल, क्षार और लवण (तालिका 15), जो घुलनशीलता के प्रकार को इंगित करता है, चिह्नित पदार्थ जो विज्ञान को ज्ञात नहीं हैं (प्राप्त नहीं) या पानी से पूरी तरह से विघटित।
तालिका में प्रयुक्त कन्वेंशन:
"पी" एक अत्यधिक घुलनशील पदार्थ है
"एम" - खराब घुलनशील पदार्थ
"एन" - व्यावहारिक रूप से अघुलनशील पदार्थ
"-" - पदार्थ प्राप्त नहीं हुआ (मौजूद नहीं है)
"- पदार्थ अनिश्चित काल तक पानी के साथ मिश्रित होता है
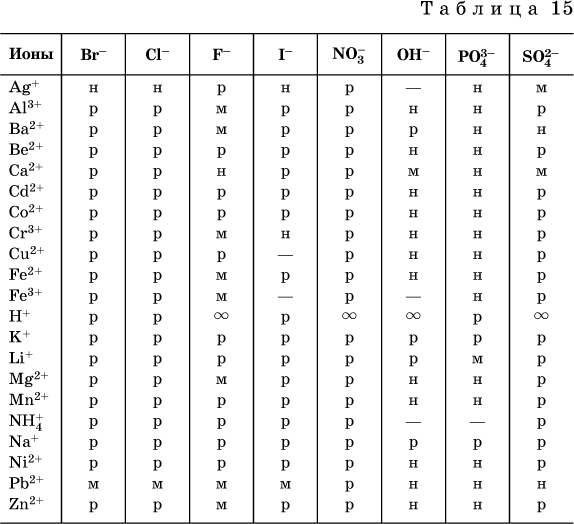
ध्यान दें। यह तालिका पदार्थ (एकत्रीकरण की उपयुक्त अवस्था में) को पानी में डालकर कमरे के तापमान पर एक संतृप्त घोल तैयार करने से मेल खाती है। यह ध्यान दिया जाना चाहिए कि आयन एक्सचेंज प्रतिक्रियाओं का उपयोग करके खराब घुलनशील पदार्थों के अवक्षेप प्राप्त करना हमेशा संभव नहीं होता है (अधिक विवरण के लिए 13.4 देखें)।




