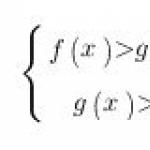V roku 2018 bola VPR z chémie v 11. ročníku vykonaná rozhodnutím vzdelávacej organizácie pre absolventov, ktorí si tento predmet na zloženie skúšky nezvolili.
Verzie 2018 sa vám budú hodiť pri príprave na CDF 2019.
VPR z chémie ročník 11 2018 možnosti + odpovede
Overovacia práca v chémii je podmienene rozdelená do štyroch obsahových blokov: „Teoretické základy chémie“, „Anorganická chémia“, „Organická chémia“, „Metódy učenia chémie. Experimentálne základy chémie. Chémia a život.
Absolventi, ktorí sa zúčastňujú na písaní VLOOKUP v chémii, musia preukázať základnú úroveň vedomostí z predmetu:
- napíšte rovnicu pre chemickú reakciu
- simulovať chemický experiment na základe jeho popisu,
- vysvetliť podmienenosť vlastností a spôsobov získavania látok ich zložením a štruktúrou.
Testovacia práca pre ročník 11 obsahuje 15 úloh rôznej úrovne zložitosti.
Na dokončenie celej práce je poskytnutých 1,5 hodiny (90 minút).
Úlohy zahrnuté v teste kontrolujú zvládnutie práce
absolventi s určitými zručnosťami a metódami konania, ktoré
spĺňať požiadavky na úroveň prípravy absolventov.
Tabuľka na prevod skóre VLOOKUP chémie na hodnotenie
Stredné všeobecné vzdelanie
Linka UMK VV Lunin. Chémia (10-11) (základná)
Linka UMK VV Lunin. Chémia (10-11) (U)
Linka UMK N. E. Kuznecovovej. Chémia (10-11) (základná)
Linka UMK N. E. Kuznecovovej. Chémia (10-11) (hlboká)
VPR v chémii. 11. ročník
Testovacia práca obsahuje 15 úloh. Na dokončenie práce v chémii je pridelená 1 hodina 30 minút (90 minút).
Odpovede na úlohy napíšte do príslušného poľa. Ak napíšete nesprávnu odpoveď, prečiarknite ju a napíšte vedľa nej novú.
Pri vykonávaní práce je povolené používať:
- Periodický systém chemických prvkov D.I. Mendelejev;
- tabuľka rozpustnosti solí, kyselín a zásad vo vode;
- elektrochemické série napätí kovov;
- neprogramovateľná kalkulačka.
Pri dokončovaní úloh môžete použiť koncept. Koncepty nebudú kontrolované ani hodnotené.
Odporúčame vám dokončiť úlohy v poradí, v akom sú zadané. Ak chcete ušetriť čas, preskočte úlohu, ktorú nemôžete dokončiť hneď, a prejdite na ďalšiu. Ak vám po dokončení všetkej práce zostane čas, môžete sa vrátiť k zmeškaným úlohám.
Body, ktoré získate za splnené úlohy, sa sčítajú. Pokúste sa splniť čo najviac úloh a získať čo najviac bodov.
Prajeme vám úspech!
Z kurzu chémie poznáte nasledujúce metódy oddeľovania zmesí: usadzovanie, filtrovanie, destilácia (destilácia), pôsobenie magnetu, odparovanie, kryštalizácia.
Na obr. 1-3 sú uvedené príklady použitia niektorých z týchto metód.
Určite, ktorá z metód na separáciu zmesí znázornených na obrázku sa môže použiť na separáciu:
- obilniny a železné piliny, ktoré sa do nej dostali;
- voda a v nej rozpustené soli.
Do tabuľky zapíšte číslo obrázku a názov zodpovedajúcej metódy delenia zmesi.
Riešenie
1.1. Separácia zmesi obilnín a železných pilín je založená na vlastnosti železa byť priťahované magnetom. Obrázok 3

1.2. Počas destilácie dochádza k oddeleniu zmesi vody a rozpustených solí. Voda sa po zahriatí na bod varu vyparí a ochladením vo vodnom chladiči prúdi do vopred pripravenej nádoby. Obrázok 1.

Na obrázku je znázornený diagram rozloženia elektrónov na energetických úrovniach atómu určitého chemického prvku.

Na základe navrhovanej schémy vykonajte nasledujúce úlohy:
- zapíšte si značku chemického prvku, ktorému zodpovedá daný model atómu;
- zapíšte si číslo periódy a číslo skupiny v Periodickej sústave chemických prvkov D.I. Mendelejev, v ktorom sa tento prvok nachádza;
- určiť, či jednoduchá látka tvoriaca tento prvok patrí medzi kovy alebo nekovy.
Zaznamenajte svoje odpovede do tabuľky.
Riešenie
Obrázok ukazuje schému štruktúry atómu:

Kde je zobrazené jadro so špecifickým kladný náboj(n) a elektróny rotujúce okolo jadra na elektrónových vrstvách. Na základe toho sú požiadaní, aby pomenovali tento prvok, zapísali číslo obdobia a skupinu, v ktorej sa nachádza. Poďme na to:
- Elektróny rotujú na troch elektrónových vrstvách, čo znamená, že prvok sa nachádza v tretej perióde.
- Na poslednej elektrónovej vrstve rotuje 5 elektrónov, čo znamená, že prvok sa nachádza v 5. skupine.
Úloha 3
Periodický systém chemických prvkov D.I. Mendelejev je bohatým zdrojom informácií o chemických prvkoch, ich vlastnostiach a vlastnostiach ich zlúčenín. Napríklad je známe, že so zvýšením atómového čísla chemického prvku sa základný charakter oxidu v periódach znižuje a zvyšuje sa v skupinách.
Vzhľadom na tieto vzorce usporiadajte nasledujúce prvky v poradí, v akom posilňujú zásaditosť oxidov: Na, Al, Mg, B. Napíšte symboly prvkov v požadovanom poradí.
Odpoveď: ________
Riešenie
Ako viete, súčet protónov v jadre atómu sa rovná poradovému číslu prvku. Ale počet protónov nám nie je daný. Keďže atóm je elektricky neutrálna častica, počet protónov (kladne nabitých častíc) v jadre atómu sa rovná počtu elektrónov (záporne nabitých častíc) obiehajúcich okolo jadra atómu. Celkový počet elektrónov obiehajúcich okolo jadra je 15 (2 + 8 + 5), preto je poradové číslo prvku 15. Teraz zostáva pozrieť sa do periodického systému chemických prvkov DI Mendelejeva a nájsť číslo 15 Toto je P (fosfor). Keďže fosfor má v poslednej elektrónovej vrstve 5 elektrónov, je nekovový; kovy na poslednej vrstve majú 1 až 3 elektróny.
Dané 4 prvky z periodickej sústavy Mendelejeva: Na, Al, Mg, B. Je potrebné ich usporiadať tak, aby sa zvýšila zásaditosť nimi tvorených oxidov. Pri odpovedi na túto otázku VPR je potrebné pamätať na to, ako sa menia vlastnosti kovov v obdobiach a skupinách periodického systému.
V obdobiach zľava doprava sa kovové vlastnosti znižujú a nekovové vlastnosti sa zvyšujú. V dôsledku toho sa tiež znižuje zásaditosť oxidov.
V skupinách, hlavných podskupinách, sa kovové vlastnosti zvyšujú zhora nadol. V dôsledku toho sa zásaditosť ich oxidov tiež zvyšuje v rovnakom poradí.
Teraz sa pozrime na prvky, ktoré nám boli dané. Dvaja z nich sú v tretej skupine; sú to B a Al. Hliník v skupine je nižší ako bór, preto sú jeho kovové vlastnosti výraznejšie ako vlastnosti bóru. V súlade s tým je zásaditosť oxidu hlinitého výraznejšia.
Al, Na a Mg sa nachádzajú v 3. perióde. Keďže sa vlastnosti kovov v perióde zľava doprava znižujú, znižujú sa aj základné vlastnosti ich oxidov. Vzhľadom na to všetko môžete tieto prvky usporiadať v nasledujúcom poradí:
Úloha 4
Nižšie uvedená tabuľka ukazuje niektoré charakteristiky kovalentných a iónových typov chemickej väzby.
Pomocou týchto informácií určite typ chemickej väzby: 1) v chloride vápenatom (CaCl 2); 2) v molekule vodíka (H2).
- V chloride vápenatom ______________
- V molekule vodíka _____________
Riešenie
V ďalšej otázke je potrebné určiť, ktorý typ chemickej väzby je typický pre CaCl 2 a ktorý pre H 2 . Táto tabuľka má tip:
Pomocou nej možno určiť, že CaCl 2 je charakterizovaný iónovým typom väzby, keďže pozostáva z atómu kovu (Ca) a nekovových atómov (Cl) a pre H 2 je kovalentný nepolárny, keďže táto molekula pozostáva z atómov toho istého prvku, ktorým je vodík.
Komplexné anorganické látky môžu byť podmienene rozdelené, to znamená klasifikované, do štyroch tried, ako je znázornené na diagrame. Do tejto schémy zadajte chýbajúce názvy dvoch tried a dva vzorce látok, ktoré sú zástupcami zodpovedajúcich tried.

Riešenie
Ďalšou úlohou je preveriť znalosti o hlavných triedach anorganických látok.
Tabuľka musí vyplniť prázdne bunky. V prvých dvoch prípadoch sú uvedené vzorce látok, je potrebné ich priradiť k určitej triede látok; do posledných dvoch naopak napíšte vzorce pre zástupcov týchto tried.
CO 2 je komplexná látka pozostávajúca z atómov rôznych prvkov. Jedným z nich je kyslík. Je na druhom mieste. Je to oxid. Všeobecný vzorec pre oxidy je RO, kde R je špecifický prvok.
RbOH - patrí do triedy zásad. Všetkým zásadám je spoločná prítomnosť OH skupiny, ktorá je spojená s kovom (výnimkou je NH 4 OH, kde je OH skupina naviazaná na NH 4 skupinu).
Kyseliny sú zložité látky pozostávajúce z atómov vodíka a zvyškov kyseliny.
Preto vzorce všetkých kyselín začínajú atómami vodíka, po ktorých nasleduje zvyšok kyseliny. Napríklad: HCl, H 2 SO 4, HNO 3 atď.
Nakoniec napíšte vzorec pre soľ. Soli sú komplexné látky pozostávajúce z atómov kovov a kyslého zvyšku, napríklad NaCl, K2S04.

Na dokončenie úloh 6-8 použite informácie uvedené v tomto texte
Oxid fosforečný (P 2 O 5) vzniká pri spaľovaní fosforu na vzduchu a je to biely prášok. Táto látka je veľmi aktívna a reaguje s vodou za uvoľňovania veľkého množstva tepla, preto sa používa ako vysúšadlo plynov a kvapalín, vodu odstraňujúce činidlo v organických syntézach.
Reakčným produktom oxidu fosforečného s vodou je kyselina fosforečná (H3PO4). Táto kyselina vykazuje všetky všeobecné vlastnosti kyselín, napríklad interaguje so zásadami. Takéto reakcie sa nazývajú neutralizačné reakcie.
Najširšie uplatnenie nachádzajú soli kyseliny fosforečnej, ako je fosforečnan sodný (Na 3 PO 4). Zavádzajú sa do zloženia detergentov a pracích práškov, ktoré sa používajú na zníženie tvrdosti vody. Súčasne prenikanie nadbytočných množstiev fosforečnanov s odpadovou vodou do vodných útvarov prispieva k rýchlemu rozvoju rias (vodný kvet), čo si vyžaduje starostlivú kontrolu obsahu fosforečnanov v odpadových vodách a prírodných vodách. Na detekciu fosforečnanového iónu možno použiť reakciu s dusičnanom strieborným (AgNO 3), ktorá je sprevádzaná tvorbou žltej zrazeniny fosforečnanu strieborného (Ag 3 PO 4)
Úloha 6
1) Napíšte rovnicu pre reakciu fosforu s kyslíkom.
Odpoveď: ________
2) Na akej vlastnosti oxidu fosforečného je založené jeho použitie ako sušidla?
Odpoveď: ________
Riešenie
V tejto úlohe je potrebné sformulovať rovnicu pre reakciu fosforu s kyslíkom a odpovedať na otázku, prečo sa produkt tejto reakcie používa ako sušidlo.
Napíšeme reakčnú rovnicu a usporiadame koeficienty: 4 P + 5 O 2 = 2 P 2 O 5
Oxid fosforečný sa používa ako sušidlo pre svoju schopnosť odstraňovať vodu z látok.
Úloha 7
1) Napíšte molekulovú rovnicu pre reakciu medzi kyselinou fosforečnou a hydroxidom sodným.
Odpoveď: ________
2) Uveďte, k akému typu reakcií (zlúčeniny, rozklady, substitúcie, výmeny) patrí interakcia kyseliny fosforečnej s hydroxidom sodným.
Odpoveď: ________
Riešenie
V siedmej úlohe je potrebné zostaviť rovnicu pre reakciu medzi kyselinou fosforečnou a hydroxidom sodným. Aby sme to dosiahli, je potrebné si uvedomiť, že táto reakcia sa týka výmenných reakcií, keď si komplexné látky vymieňajú svoje zložky.
H 3 PO 4 + 3 NaOH = Na 3 PO 4 + 3 H 2 O
Tu vidíme, že vodík a sodík v produktoch reakcie sú obrátené.
Úloha 8
1) Napíšte skrátenú iónovú rovnicu pre reakciu medzi roztokmi fosforečnanu sodného (Na 3 PO 4) a dusičnanu strieborného.
Odpoveď: ________
2) Uveďte znak tejto reakcie.
Odpoveď: ________
Riešenie
Napíšme reakčnú rovnicu v redukovanej iónovej forme medzi roztokmi fosforečnanu sodného a dusičnanu strieborného.
Podľa môjho názoru je potrebné najprv napísať reakčnú rovnicu v molekulárnej forme, potom usporiadať koeficienty a určiť, ktorá z látok opúšťa reakčné prostredie, to znamená, že sa zráža, uvoľňuje sa vo forme plynu alebo vytvára nízko- disociujúca látka (napríklad voda). Pomôže nám v tom tabuľka rozpustnosti.
Na 3 PO 4 + 3 AgNO 3 = Ag 3 PO 4 + 3 NaNO 3
Šípka nadol vedľa fosforečnanu strieborného označuje, že táto zlúčenina je nerozpustná vo vode a vyzráža sa, preto nepodlieha disociácii a je zapísaná vo forme molekuly v rovniciach iónovej reakcie. Napíšeme úplnú iónovú rovnicu pre túto reakciu:
Teraz prečiarkneme ióny, ktoré sa presunuli z ľavej strany rovnice na pravú stranu bez toho, aby sa zmenil ich náboj:
3Na + + PO 4 3– + 3Ag + + 3NO 3 – = Ag 3 PO 4 + 3Na + + 3NO 3 –
Všetko, čo nie je prečiarknuté, zapíšeme do skrátenej iónovej rovnice:
PO 4 3– + 3Ag + = Ag3PO4
Úloha 9
Je uvedená schéma redoxnej reakcie.
Mn (OH)2 + KBr03 -> Mn02 + KBr + H20
1. Urobte elektronickú rovnováhu tejto reakcie.
Odpoveď: ________
2. Špecifikujte oxidačné činidlo a redukčné činidlo.
Odpoveď: ________
3. Usporiadajte koeficienty v rovnici reakcie.
Odpoveď: ________
Riešenie
Ďalšou úlohou je vysvetliť redoxný proces.
Mn(OH)2 + KBr03 -> Mn02 + KBr + H20
Aby sme to dosiahli, napíšeme vedľa symbolu každého prvku jeho oxidačný stav v tejto zlúčenine. Nezabudnite, že celkovo sú všetky oxidačné stavy látky rovné nule, pretože sú elektricky neutrálne. Oxidačný stav atómov a molekúl pozostávajúcich z rovnakej látky je tiež nulový.
Mn 2+ (O 2– H +) 2 + K + Br 5+ O 3 2– → Mn 4+ O 2 2– + K + Br – + H 2 + O 2 –
Mn2+ (02– H+)2 + K+Br5+ O32– → Mn4+ O 2 2– + K + Br – + H 2 + O 2 –
Mn 2+ –2e → Mn 4+ Proces darovania elektrónov je oxidácia. Súčasne sa počas reakcie zvyšuje oxidačný stav prvku. Tento prvok je redukčné činidlo, obnovuje bróm.
Br 5+ +6e → Br - Proces prijímania elektrónov - obnova. V tomto prípade sa oxidačný stav prvku počas reakcie znižuje. Tento prvok je oxidačným činidlom, oxiduje mangán.
Oxidačné činidlo je látka, ktorá prijíma elektróny a zároveň sa redukuje (znižuje sa oxidačný stav prvku).
Redukčné činidlo je látka, ktorá daruje elektróny a zároveň sa oxiduje (zníži sa oxidačný stav prvku). V škole sa to píše nasledovne.
Číslo 6, ktoré stojí za prvou zvislou čiarou, je najmenším spoločným násobkom čísel 2 a 6 - počtu elektrónov odovzdaných redukčným činidlom a prijatých oxidačným činidlom. Tento údaj vydelíme počtom elektrónov darovaných redukčným činidlom a dostaneme číslo 3, je umiestnené za druhou zvislou čiarou a je koeficientom v rovnici redoxnej reakcie, ktorá je umiestnená pred redukčným činidlom, že je mangán. Ďalej vydeľte číslo 6 číslom 6 - počtom elektrónov prijatých oxidačným činidlom. Dostaneme číslo 1. Toto je koeficient, ktorý je v rovnici redoxnej reakcie umiestnený pred oxidačným činidlom, teda brómom. Koeficienty zadáme do redukovanej rovnice a potom ich prenesieme do hlavnej rovnice.
3Mn(OH)2 + KBr03 → 3Mn02 + KBr + 3H20
V prípade potreby usporiadame ďalšie koeficienty tak, aby počet atómov toho istého prvku bol rovnaký. Na konci skontrolujeme počet atómov kyslíka pred a po reakcii. Ak je ich počet rovnaký, urobili sme všetko správne. V tomto prípade je potrebné dať pred vodu faktor 3.
Transformačná schéma je uvedená:
Cu → CuCl2 → Cu(OH)2 → Cu(NO3)2
Napíšte molekulové rovnice reakcií, pomocou ktorých možno tieto premeny uskutočniť.
Riešenie
Riešime transformačnú schému:
Cu→ CuCl 2 → Cu(Oh) 2 → Cu(NIE 3 ) 2
1) Cu + Cl 2 = CuCl 2 - Upozorňujem na skutočnosť, že meď neinteraguje s kyselinou chlorovodíkovou, pretože je v sérii napätí kovov po vodíku. Preto jedna z hlavných reakcií. Priama interakcia s chlórom.
2) CuCl 2 + 2 NaOH = Cu(Oh) 2 + 2 NaCl- výmenná reakcia.
3) Cu(Oh) 2 + 2 HNO 3 = Cu(NIE 3 ) 2 + 2 H 2 O-hydroxid meďnatý je zrazenina, preto soli kyseliny dusičnej nie sú vhodné na získanie dusičnanu meďnatého z nej.
Vytvorte súlad medzi názvom organickej látky a triedou/skupinou, do ktorej táto látka patrí: pre každú pozíciu označenú písmenom vyberte zodpovedajúcu pozíciu označenú číslom.
Zapíšte do tabuľky vybrané čísla pod príslušné písmená.
1. Metanol je alkohol. Názvy jednosýtnych alkoholov končia na -ol, tzv A2.
2. Acetylén je nenasýtený uhľovodík. Tento triviálny názov je uvedený tu. Podľa systematického názvoslovia je tzv ethin. Vyberte si B4.
3. Glukóza je sacharid, monosacharid. Preto si vyberáme V 1.
Do navrhovaných schém chemických reakcií vložte vzorce chýbajúcich látok a tam, kde je to potrebné, umiestnite koeficienty.
|
1) C6H6 + Br2 |
C6H5-Br + ... |
2) CH3CHO + ... → CH3CH3OH
Riešenie
Je potrebné vložiť vzorce chýbajúcich látok a v prípade potreby usporiadať koeficienty:
1) C 6 H 6 + Br 2 ⎯AlBr 3 → C 6 H 5 –Br + HBr Substitučné reakcie sú charakteristické pre benzén a jeho homológy, preto v tejto reakcii nahrádza atóm vodíka v benzéne bróm a získava sa brómbenzén.
2) CH 3 CHO + H 2 → CH 3 CH 2 OH Reakcia redukcie acetaldehydu na etylalkohol.
Kyselina octová je široko používaná v chemickom a potravinárskom priemysle. Vodné roztoky kyseliny octovej (prísada do potravín E260) sa používajú pri varení v domácnostiach, konzervovaní, ako aj pri výrobe liečivých a aromatických látok. Posledne uvedené zahŕňajú početné estery kyseliny octovej, ako je propylacetát.
Vypočítajte, koľko gramov propylacetátu (CH 3 COOC 3 H 7) možno získať reakciou 300 g kyseliny octovej (CH 3 COOH) s propanolom-1 (C 3 H 7 OH) pri praktickom výťažku 100 %. Napíšte reakčnú rovnicu a podrobné riešenie úlohy.
Odpoveď: ________
Úloha. Napíšeme stručný stav problému:
m (CH 3 COOS 3 H 7) \u003d?
1. Podmienka úlohy hovorí, že kyselina octová reagovala s hmotnosťou 300 g. Určme počet mólov v jej 300 g. Na to používame magický trojuholník, kde n je počet mólov.

Nahrádzame čísla: n \u003d 300 g: 60 g / mol \u003d 5 mol. Kyselina octová teda reagovala s propylalkoholom v množstve 5 mol. Ďalej určíme, koľko mólov CH 3 COOS 3 H 7 vznikne z 5 mólov CH 3 COOH. Podľa reakčnej rovnice kyselina octová reaguje v množstve 1 mol a tiež vzniká 1 mol esteru, pretože v reakčnej rovnici nie sú žiadne koeficienty. Ak teda vezmeme kyselinu v množstve 5 mol, potom éter bude tiež 5 mol. Pretože reagujú v pomere 1:1.
Zostáva vypočítať hmotnosť 5 mólov éteru pomocou tohto trojuholníka.
Nahradením čísel dostaneme: 5 mol 102 g / mol \u003d 510 g.
odpoveď: hmotnosť éteru = 510 g.
Acetylén sa používa ako palivo na zváranie plynom a rezanie kovov, ako aj surovina na výrobu vinylchloridu a iných organických látok. V súlade s nižšie uvedenou schémou napíšte rovnice pre reakcie charakteristické pre acetylén. Pri písaní reakčných rovníc používajte štruktúrne vzorce organických látok.

Riešenie
Vykonajte transformácie charakteristické pre acetylén podľa vyššie uvedenej schémy.
Chcel by som povedať, že acetylén je nenasýtený uhľovodík s 2 π-väzbami medzi atómami uhlíka, preto sa vyznačuje adičnými, oxidačnými, polymerizačnými reakciami v mieste pretrhnutia π-väzieb. Reakcie môžu prebiehať v dvoch fázach.

Ringerov roztok je široko používaný v medicíne ako regulátor rovnováhy voda-soľ, náhrada plazmy a iných zložiek krvi. Na jeho prípravu sa v 1 litri destilovanej vody rozpustí 8,6 g chloridu sodného, 0,33 g chloridu vápenatého a 0,3 g chloridu draselného. Vypočítajte hmotnostný zlomok chloridu sodného a chloridu vápenatého vo výslednom roztoku. Napíšte podrobné riešenie problému.
Odpoveď: ________
Riešenie
Na vyriešenie tohto problému napíšeme jeho stručnú podmienku:
|
m(H20) \u003d 1000 g. m(CaCl2) \u003d 0,33 g. m(KCI) = 0,3 g. m(NaCl) = 8,6 g. |
Keďže hustota vody je jednotná, 1 liter vody bude mať hmotnosť rovnajúcu sa 1000 gramom. Ďalej, aby sme našli hmotnostný zlomok v percentách riešenia, použijeme magický trojuholník,
m (in-va) - hmotnosť látky; m(r-ra) - hmotnosť roztoku; ω je hmotnostný zlomok látky v percentách v danom roztoku. Odvodíme vzorec na nájdenie ω% v roztoku. Bude to vyzerať takto:
|
|
ω% (p-ra NaCl) |
Aby sme okamžite pristúpili k zisteniu hmotnostného zlomku v percentách roztoku NaCl, musíme poznať ďalšie dve hodnoty, teda hmotnosť látky a hmotnosť roztoku. Hmotnosť látky je nám známa z podmienok problému a mala by sa nájsť hmotnosť riešenia. Hmotnosť roztoku sa rovná hmotnosti vody plus hmotnosti všetkých solí rozpustených vo vode. Vzorec na výpočet je jednoduchý: m (in-va) \u003d m (H 2 O) + m (NaCl) + m (CaCl 2) + m (KCl), spočítaním všetkých hodnôt dostaneme: 1 000 g. + 8,6 g + 0,3 g + 0,33 g = 1009,23 g Toto bude hmotnosť celého roztoku.
Teraz nájdeme hmotnostný zlomok NaCl v roztoku:
Podobne vypočítame hmotnosť chloridu vápenatého:
Po pripojení čísel dostaneme:
odpoveď: co % v roztoku NaCl = 0,85 %; w% v roztoku CaCl2 = 0,033 %.
VPR celoruská overovacia práca – chémia 11. ročník
Vysvetlivky k vzorke celoruskej overovacej práce
Pri oboznamovaní sa so vzorovou testovacou prácou je potrebné mať na pamäti, že úlohy zahrnuté vo vzorke neodrážajú všetky zručnosti a problémy s obsahom, ktoré budú testované v rámci celoruskej testovacej práce. Kompletný zoznam obsahových prvkov a zručností, ktoré je možné v práci otestovať, je uvedený v kodifikátore obsahových prvkov a požiadaviek na úroveň prípravy absolventov pre vypracovanie celoruského testovacieho diela z chémie. Účelom vzorky testovacej práce je poskytnúť predstavu o štruktúre celoruskej testovacej práce, počte a forme úloh a ich úrovni zložitosti.
Pracovné pokyny
Testovacia práca obsahuje 15 úloh. Na dokončenie práce v chémii je pridelená 1 hodina 30 minút (90 minút).
Odpovede pripravte v texte práce podľa pokynov k úlohám. Ak napíšete nesprávnu odpoveď, prečiarknite ju a napíšte vedľa nej novú.
Pri vykonávaní práce je povolené používať nasledujúce dodatočné materiály:
– Periodická sústava chemických prvkov D.I. Mendelejev;
- tabuľka rozpustnosti solí, kyselín a zásad vo vode;
– elektrochemický rad napätí kovov;
- neprogramovateľná kalkulačka.
Pri dokončovaní úloh môžete použiť koncept. Koncepty nebudú kontrolované ani hodnotené.
Odporúčame vám dokončiť úlohy v poradí, v akom sú zadané. Ak chcete ušetriť čas, preskočte úlohu, ktorú nemôžete dokončiť hneď, a prejdite na ďalšiu. Ak vám po dokončení všetkej práce zostane čas, môžete sa vrátiť k zmeškaným úlohám.
Body, ktoré získate za splnené úlohy, sa sčítajú. Pokúste sa splniť čo najviac úloh a získať čo najviac bodov.
Prajeme vám úspech!
1. Z kurzu chémie poznáte nasledujúce spôsoby delenia zmesí: sedimentácia, filtrácia, destilácia (destilácia), pôsobenie magnetu, odparovanie, kryštalizácia. Obrázky 1-3 zobrazujú príklady niektorých z týchto metód.
Ktorú z nasledujúcich metód separácie zmesí možno použiť na čistenie:
1) múka zo železných pilín, ktoré sa do nej dostali;
2) voda z anorganických solí v nej rozpustených?
Do tabuľky zapíšte číslo obrázku a názov zodpovedajúcej metódy delenia zmesi.
železné piliny sú priťahované magnetom
pri destilácii po kondenzácii vodnej pary zostávajú v nádobe kryštály soli
2. Na obrázku je znázornený model elektrónovej štruktúry atómu nejakej chemikálieelement.

Na základe analýzy navrhovaného modelu vykonajte nasledujúce úlohy:
1) určiť chemický prvok, ktorého atóm má takúto elektrónovú štruktúru;
2) uveďte číslo periódy a číslo skupiny v periodickom systéme chemických prvkov D.I. Mendelejev, v ktorom sa tento prvok nachádza;
3) určiť, či jednoduchá látka, ktorá tvorí tento chemický prvok, patrí medzi kovy alebo nekovy.
Zaznamenajte svoje odpovede do tabuľky.
odpoveď:
N; 2; 5 (alebo V); nekovové
na určenie chemického prvku by ste mali vypočítať celkový počet elektrónov, ktorý vidíme na obrázku (7)
z periodickej tabuľky môžeme ľahko určiť prvok (počet nájdených elektrónov sa rovná atómovému číslu prvku) (N-dusík)
potom určíme číslo skupiny (vertikálny stĺpec) (5) a povahu tohto prvku (nekov)
3. Periodický systém chemických prvkov D.I. Mendelejev- bohaté úložisko informácií o chemických prvkoch, ich vlastnostiach a vlastnostiach ich zlúčenín, o zákonitostiach zmien týchto vlastností, o metódach získavania látok, ako aj o ich prítomnosti v prírode. Napríklad je známe, že s nárastom poradového čísla chemického prvku v periódach sa polomery atómov zmenšujú a v skupinách sa zväčšujú.
Vzhľadom na tieto vzory usporiadajte nasledujúce prvky v poradí podľa rastúcich atómových polomerov: N, C, Al, Si. Zapíšte si označenia prvkov v správnom poradí.
Odpoveď: _____________________________
N → C → Si → Al
4. V tabuľke nižšie sú uvedené charakteristické vlastnosti látok, ktoré majú molekulárnu a iónovú štruktúru.
Pomocou týchto informácií určite, akú štruktúru majú látky dusík N2 a kuchynská soľ NaCl. Svoju odpoveď napíšte na určené miesto:
1) dusík N2 _________________________________________________________________
2) kuchynská soľ NaCl __________________________________________________
dusík N2 - molekulárna štruktúra;
kuchynská soľ NaCl - iónová štruktúra
5. Komplexné anorganické látky môžu byť podmienene rozdelené, to znamená klasifikované, do štyroch skupín, ako je znázornené na diagrame. V tejto schéme zadajte pre každú zo štyroch skupín chýbajúce názvy skupín alebo chemické vzorce látok (jeden príklad vzorcov) patriacich do tejto skupiny.

Zaznamenávajú sa názvy skupín: zásady, soli;
zapisujú sa vzorce látok zodpovedajúcich skupín
CaO, zásady, HCl, soli
Prečítajte si nasledujúci text a vykonajte úlohy 6-8.
V potravinárstve sa používa potravinárska prídavná látka E526, čo je hydroxid vápenatý Ca (OH) 2. Uplatnenie nachádza pri výrobe: ovocných štiav, detskej výživy, nakladaných uhoriek, kuchynskej soli, cukroviniek a sladkostí.
Výroba hydroxidu vápenatého v priemyselnom meradle je možná zmiešaním oxidu vápenatého s vodou, tento proces sa nazýva kalenie.
Hydroxid vápenatý sa široko používa pri výrobe stavebných materiálov, ako sú malty, omietky a sadrové malty. Je to kvôli jeho schopnostiam interagovať s oxidom uhličitým CO2 obsiahnuté vo vzduchu. Rovnaká vlastnosť roztoku hydroxidu vápenatého sa používa na meranie množstva oxidu uhličitého vo vzduchu.
Užitočnou vlastnosťou hydroxidu vápenatého je jeho schopnosť pôsobiť ako flokulant, ktorý čistí odpadovú vodu od suspendovaných a koloidných častíc (vrátane solí železa). Používa sa aj na zvýšenie pH vody, keďže prírodná voda obsahuje látky (napr. kyseliny), čo spôsobuje koróziu vo vodovodnom potrubí.
1. Napíšte molekulovú rovnicu reakcie za vzniku hydroxidu vápenatého, ktorý
uvedené v texte.
2. Vysvetlite, prečo sa tento proces nazýva kalenie.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
1) CaO + H20 \u003d Ca (OH) 2
2) Pri interakcii oxidu vápenatého s vodou vzniká veľké množstvo
množstvo tepla, takže voda vrie a syčí, ako keby narážala na žeravé uhlie, keď sa oheň hasí vodou (alebo „hasenie tohto procesu sa nazýva, pretože v dôsledku toho vzniká hasené vápno“)
1. Napíšte molekulovú rovnicu pre reakciu medzi hydroxidom vápenatým a oxidom uhličitým
plyn, ktorý bol v texte uvedený.
Odpoveď: ___________________________________________________________________________
2. Vysvetlite, aké vlastnosti tejto reakcie umožňujú jej zisťovanie
oxid uhličitý vo vzduchu.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH)2 + C02 = CaC03↓ + H20
2) V dôsledku tejto reakcie sa vytvorí nerozpustná látka - uhličitan vápenatý, pozoruje sa zakalenie pôvodného roztoku, čo umožňuje posúdiť prítomnosť oxidu uhličitého vo vzduchu (kvalitatívne
reakcia na CO2)
1. Zostavte skrátenú iónovú rovnicu reakcie uvedenej v texte medzi
hydroxid vápenatý a kyselina chlorovodíková.
Odpoveď: ___________________________________________________________________________
2. Vysvetlite, prečo sa táto reakcia používa na zvýšenie pH vody.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH - + H+ = H20 (Ca(OH)2+ 2HCl = CaCl2 + 2H20)
2) Prítomnosť kyselín v prírodnej vode spôsobuje nízke hodnoty pH tejto vody. Hydroxid vápenatý neutralizuje kyseliny a hodnoty pH stúpajú
Stupnica pH existuje od 0 do 14. od 0-6 - kyslé prostredie, 7 - neutrálne prostredie, 8-14 - alkalické prostredie
9. Je uvedená schéma redoxnej reakcie.
H2S + Fe203 → FeS + S + H20
1. Urobte elektronickú rovnováhu tejto reakcie.
Odpoveď: ___________________________________________________________________________
2. Špecifikujte oxidačné činidlo a redukčné činidlo.
Odpoveď: ___________________________________________________________________________
3. Usporiadajte koeficienty v rovnici reakcie.
Odpoveď: ___________________________________________________________________________
1) Zostavená elektronická váha:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 - 2ē → S 0 | 2 | 1 |
2) Uvádza sa, že síra v oxidačnom stave –2 (alebo H 2 S) je redukčné činidlo a železo v oxidačnom stave +3 (alebo Fe 2 O 3) je oxidačné činidlo;
3) Reakčná rovnica sa skladá:
3H2S + Fe2O3 \u003d 2FeS + S + 3H20
10. Schéma transformácií je uvedená:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Napíšte rovnice molekulárnej reakcie, ktoré možno použiť na uskutočnenie
naznačené transformácie.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
Reakčné rovnice zodpovedajúce transformačnej schéme sú napísané:
1) Fe + 2HCl = FeCl2 + H2
2) FeCl2 + 2AgN03 \u003d Fe (N03)2 + 2AgCl
3) Fe(N03)2 + 2KOH = Fe(OH)2 + 2KN03
(Iné, ktoré nie sú v rozpore s podmienkou stanovenia rovnice, sú povolené
reakcie.)
11. Vytvorte súlad medzi vzorcom organickej hmoty a triedou / skupinou do ktorej táto látka patrí: pre každú pozíciu označenú písmenom vyberte zodpovedajúcu pozíciu označenú číslom.
Zapíšte do tabuľky vybrané čísla pod príslušné písmená.
odpoveď:
| A | B | V |
- C3H8 - CnH2n + 2 - alkán
- C3H6 - CnH2n- alkén
- C2H6O - CnH2n + 2O- alkohol
12. Do navrhovaných schém chemických reakcií vložte vzorce chýbajúcich látok a usporiadajte koeficienty.
1) C2H6 + …………………..… → C2H5Cl + HCl
2) C3H6 + …………………..... → CO2 + H20
1) C2H6 + Cl2 -> C2H5CI + HCl
2) 2C3H6 + 902 → 6CO2 + 6H20
(Je možný zlomkový kurz.)
13. Propán horí s nízkymi emisiami toxických látok do atmosféry, preto sa používa ako zdroj energie v mnohých oblastiach, napríklad v plynových zapaľovačoch a na vykurovanie vidieckych domov.
Aký objem oxidu uhličitého (N.O.) vznikne pri úplnom spálení 4,4 g propánu?
Napíšte podrobné riešenie problému.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Bola zostavená rovnica pre reakciu spaľovania propánu:
C3H8 + 502 -> 3C02 + 4H20
2) n (C3H8) \u003d 4,4 / 44 \u003d 0,1 mol
n (CO 2) \u003d 3n (C3H8) \u003d 0,3 mol
3) V (O 2) \u003d 0,3 22,4 \u003d 6,72 l
14. Izopropylalkohol sa používa ako univerzálne rozpúšťadlo: je súčasťou domácich chemikálií, parfumov a kozmetiky, kvapalín do ostrekovačov automobilov. V súlade s nižšie uvedenou schémou zostavte rovnice pre reakcie na získanie tohto alkoholu. Pri písaní reakčných rovníc používajte štruktúrne vzorce organických látok.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Reakčné rovnice sú napísané podľa schémy:

(Povolené sú aj iné, ktoré nie sú v rozpore s podmienkou stanovenia reakčnej rovnice.)
15. Fyziologický roztok v medicíne sa nazýva 0,9% roztok chloridu sodného vo vode. Vypočítajte hmotnosť chloridu sodného a hmotnosť vody potrebnej na prípravu 500 g fyziologického roztoku. Napíšte podrobné riešenie problému.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCI) = 4,5 g
2) m(voda) = 495,5 g
m(r-ra) = 500 g m(soľ) = x
x/500 * 100 %= 0,9 %
m (soli) = 500* (0,9/100) = 4,5 g
© 2017 Federálna služba pre dohľad vo vzdelávaní a vede Ruskej federácie
Dňa 27.04.2017 sa po prvýkrát uskutočnila celoruská overovacia práca VPR v chémii v 11 triedach v testovacom režime.
Oficiálna webová stránka VPR (StatGrad)- vpr.statgrad.org
Možnosti VPR v chémii 11. ročník 2017
| № | Stiahnite si odpovede (kritériá hodnotenia) |
| Možnosť 11 | odpovede |
| Možnosť 12 | odpovede |
| Možnosť 13 | odpovede |
| Možnosť 14 | odpovede |
| Možnosť 15 | odpoveď na možnosť 15 |
| Možnosť 16 | odpoveď na možnosť 16 |
| Možnosť 17 | odpoveď na možnosť 17 |
| Možnosť 18 | odpoveď na možnosť 18 |
Na zoznámenie sa s príkladnými možnosťami práce na oficiálnej webovej stránke FIPI sú zverejnené ukážkové možnosti s odpoveďami a popismi.
Vzorky VPR z chémie 11. ročník 2017 (demo verzia)
Testovacia práca obsahuje 15 úloh. Na dokončenie práce v chémii je pridelená 1 hodina 30 minút (90 minút).
Pri vykonávaní práce je povolené používať nasledujúce dodatočné materiály:
– Periodická sústava chemických prvkov D.I. Mendelejev;
- tabuľka rozpustnosti solí, kyselín a zásad vo vode;
– elektrochemický rad napätí kovov;
- neprogramovateľná kalkulačka.
Štruktúra a obsah celoruskej overovacej práce VPR v chémii
Každá verzia VLOOKUP obsahuje 15 úloh rôznych typov a úrovní zložitosti. Možnosti zahŕňajú priradenia rôznych formátov.
Tieto úlohy majú rozdiely v požadovanej forme zaznamenávania odpovede. Takže odpoveď môže byť napríklad: postupnosť čísel, symbolov; slová; vzorce látok; reakčné rovnice.
Práca obsahuje 4 úlohy so zvýšenou úrovňou zložitosti (ich poradové čísla: 9, 10, 13, 14). Tieto úlohy sú náročnejšie, pretože ich implementácia zahŕňa komplexnú aplikáciu nasledujúcich zručností:
– zostaviť reakčné rovnice, ktoré potvrdzujú vlastnosti látok a/alebo vzťah rôznych tried látok a elektrónovú rovnováhu redoxnej reakcie;
Vysvetliť podmienenosť vlastností a spôsobov získavania látok ich zložením a štruktúrou;
– modelovať chemický pokus na základe jeho popisu.
Pri dokončovaní úloh môžete použiť koncept. Koncepty nebudú kontrolované ani hodnotené.
VLOOKUP. Chémia. 11. ročník 10 možností pre typické úlohy. Drozdov A.A.

M.: 20 1 7. - 9 6 s.
Táto príručka je plne v súlade s federálnym štátnym vzdelávacím štandardom (druhá generácia). Kniha obsahuje 10 variantov typických úloh Celoruskej testovacej práce (VPR) z chémie pre žiakov 11. ročníka. Zbierka je určená pre žiakov 11. ročníka, učiteľov a metodikov, ktorí sa pomocou štandardných úloh pripravujú na celoruskú testovaciu prácu z chémie.
formát: pdf
Veľkosť: 3,4 MB
Sledujte, sťahujte:drive.google
Pracovné pokyny, 4
Možnosť 15
Možnosť 2 12
Možnosť 3 19
Možnosť 4 26
Možnosť 5 33
Možnosť 6 40
Možnosť 7 47
Možnosť 8 54
Možnosť 9 61
Možnosť 10 68
Systém hodnotenia skúšobnej práce 75
Odpovede 76
Prihlášky 93
Testovacia práca obsahuje 15 úloh. Na dokončenie práce v chémii je pridelená 1 hodina 30 minút (90 minút).
Odpovede pripravte v texte práce podľa pokynov k úlohám. Ak napíšete nesprávnu odpoveď, prečiarknite ju a napíšte vedľa nej novú.
Pri vykonávaní práce je povolené používať nasledujúce dodatočné materiály:
- Periodická sústava chemických prvkov D.I. Mendelejev;
- tabuľka rozpustnosti solí, kyselín a zásad vo vode;
- elektrochemický rad napätí kovov;
- neprogramovateľná kalkulačka.
Pri dokončovaní úloh môžete použiť koncept. Koncepty nebudú kontrolované ani hodnotené.
Odporúčame vám dokončiť úlohy v poradí, v akom sú zadané. Ak chcete ušetriť čas, preskočte úlohu, ktorú nemôžete dokončiť hneď, a prejdite na ďalšiu. Ak vám po dokončení všetkej práce zostane čas, môžete sa vrátiť k zmeškaným úlohám.
Body, ktoré získate za splnené úlohy, sa sčítajú. Pokúste sa splniť čo najviac úloh a získať čo najviac bodov.