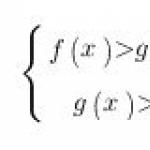विषय 6. "समाधानों का इलेक्ट्रोलिसिस और नमक पिघलता है"
1. इलेक्ट्रोलिसिस एक रेडॉक्स प्रक्रिया है जो इलेक्ट्रोड पर तब होती है जब एक विद्युत प्रवाह एक इलेक्ट्रोलाइट समाधान या पिघल के माध्यम से पारित किया जाता है।
2. कैथोड - ऋणात्मक आवेशित इलेक्ट्रोड। धातु और हाइड्रोजन धनायनों (एसिड में) या पानी के अणुओं की कमी होती है।
3. एनोड - एक धनात्मक आवेशित इलेक्ट्रोड। अम्ल अवशेषों और हाइड्रॉक्सिल समूह (क्षार में) के आयनों का ऑक्सीकरण होता है।
4. नमक के घोल के इलेक्ट्रोलिसिस के दौरान प्रतिक्रिया मिश्रण में पानी मौजूद होता है। चूंकि पानी ऑक्सीकरण और कम करने दोनों गुणों को प्रदर्शित कर सकता है, यह कैथोडिक और एनोडिक दोनों प्रक्रियाओं के लिए एक "प्रतियोगी" है।
5. अक्रिय इलेक्ट्रोड (ग्रेफाइट, कार्बन, प्लेटिनम) और एक सक्रिय एनोड (घुलनशील) के साथ-साथ पिघलने और इलेक्ट्रोलाइट समाधानों के इलेक्ट्रोलिसिस के साथ इलेक्ट्रोलिसिस होते हैं।
कैथोड प्रक्रियाएं
यदि धातु वोल्टेज की एक श्रृंखला में है:
तनावों की एक श्रृंखला में धातु की स्थिति
कैथोड पर रिकवरी
ली से अली तक
पानी के अणु कम हो जाते हैं: 2H2O + 2e- → H20+ 2OH-
एमएन से पीबी
पानी के अणुओं और धातु के पिंजरों दोनों को बहाल किया जाता है:
2H2O + 2e- → H20+ 2OH-
पुरुष+ + ने- → Me0
Cu से Au . तक
धातु के धनायन कम हो जाते हैं: Men+ + ne- → Me0
एनोडिक प्रक्रियाएं
अम्ल अवशेष
एएसएम-
एनोड
घुलनशील
(लोहा, जस्ता, तांबा, चांदी)
अघुलनशील
(ग्रेफाइट, सोना, प्लेटिनम)
ऑक्सीजन में कमी
एनोड धातु ऑक्सीकरण
0 - ने- = एमएन+
एनोड समाधान
आयनों का ऑक्सीकरण (F- को छोड़कर)
Acm- - me- = Ac0
ऑक्सीजन युक्त
फ्लोराइड - आयन (F-)
अम्लीय और तटस्थ वातावरण में:
2 H2O - 4e- → O20 + 4H+
क्षारीय वातावरण में:
4OH- - 4e- \u003d O20 + 2H2O
अक्रिय इलेक्ट्रोड के साथ पिघल इलेक्ट्रोलिसिस प्रक्रियाओं के उदाहरण
इलेक्ट्रोलाइट पिघल में, केवल इसके आयन मौजूद होते हैं, इसलिए कैथोड पर इलेक्ट्रोलाइट केशन कम हो जाते हैं, और एनोड पर आयनों का ऑक्सीकरण होता है।
1. पोटेशियम क्लोराइड के पिघलने के इलेक्ट्रोलिसिस पर विचार करें।
थर्मल पृथक्करण KCl → K+ + Cl-
K(-) K+ + 1e- → K0
ए (+) 2Cl- - 2e- → Cl02
सारांश समीकरण:
2KCl → 2K0 + Cl20
2. पिघले हुए कैल्शियम क्लोराइड के इलेक्ट्रोलिसिस पर विचार करें।
थर्मल पृथक्करण CaCl2 → Ca2+ + 2Cl-
K(-) Ca2+ + 2e- → Ca0
ए (+) 2Cl- - 2e- → Cl02
सारांश समीकरण:
CaCl2 → Ca0 + Cl20
3. पोटेशियम हाइड्रॉक्साइड के एक पिघल के इलेक्ट्रोलिसिस पर विचार करें।
KOH → K+ + OH- का ऊष्मीय पृथक्करण
K(-) K+ + 1e- → K0
ए (+) 4OH- - 4e- → O20 + 2H2O
सारांश समीकरण:
4KOH → 4K0 + O20 + 2H2O
अक्रिय इलेक्ट्रोड के साथ इलेक्ट्रोलाइट समाधान के इलेक्ट्रोलिसिस प्रक्रियाओं के उदाहरण
पिघलने के विपरीत, इलेक्ट्रोलाइट समाधान में, इसके आयनों के अलावा, पानी के अणु होते हैं। इसलिए, इलेक्ट्रोड पर प्रक्रियाओं पर विचार करते समय, उनकी भागीदारी को ध्यान में रखना आवश्यक है। एक सक्रिय धातु द्वारा गठित नमक के घोल का इलेक्ट्रोलिसिस, एल्यूमीनियम तक वोल्टेज की एक श्रृंखला में खड़ा होता है और एक ऑक्सीजन युक्त एसिड का एक अम्लीय अवशेष, पानी के इलेक्ट्रोलिसिस में कम हो जाता है। 1. मैग्नीशियम सल्फेट के एक जलीय घोल के इलेक्ट्रोलिसिस पर विचार करें। MgSO4 एक नमक है जो एक धातु द्वारा एल्यूमीनियम तक तनाव की एक श्रृंखला में खड़ा होता है और एक ऑक्सीजन युक्त एसिड अवशेष होता है। पृथक्करण समीकरण: MgSO4 → Mg2+ + SO42- K (-) 2H2O + 2e- \u003d H20 + 2OH- A (+) 2H2O - 4e- \u003d O20 + 4H + कुल समीकरण: 6H2O \u003d 2H20 + 4OH- + O20 + 4H + 2H2O \u003d 2H20 + O20 2. कॉपर (II) सल्फेट के जलीय घोल के इलेक्ट्रोलिसिस पर विचार करें। uSO4 एक कम सक्रिय धातु और एक ऑक्सीजन युक्त एसिड अवशेष द्वारा निर्मित नमक है। इस मामले में, इलेक्ट्रोलिसिस धातु, ऑक्सीजन का उत्पादन करता है, और संबंधित एसिड कैथोड-एनोड स्पेस में बनता है। वियोजन समीकरण: CuSO4 → Cu2+ + SO42- K (-) Cu2+ + 2e- = Cu0 A (+) 2H2O – 4e- = O20 + 4H+ सारांश समीकरण: 2Cu2+ + 2H2O = 2Cu0 + O20 + 4H+ 2CuSO4 + 2H2O = 2Cu0 + О20 + 2Н2SO4
3. कैल्शियम क्लोराइड के जलीय घोल के इलेक्ट्रोलिसिस पर विचार करें। CaCl2 एक नमक है जो एक सक्रिय धातु और एक ऑक्सीजन मुक्त एसिड अवशेष द्वारा बनता है। इस मामले में, इलेक्ट्रोलिसिस के दौरान हाइड्रोजन, हैलोजन बनते हैं, और कैथोड-एनोड स्पेस में क्षार का निर्माण होता है। वियोजन समीकरण: CaCl2 → Ca2+ + 2Cl- K (-) 2H2O + 2e- = H20 + 2OH- A (+) 2Cl- – 2e- = Cl20 सारांश समीकरण: 2H2O + 2Cl- = Cl20 + 2OH- CaCl2 + 2H2O = Ca (OH)2 + Cl20 + H20 4. कॉपर (II) क्लोराइड के जलीय विलयन के इलेक्ट्रोलिसिस पर विचार करें। CuCl2 एक नमक है जो एक कम सक्रिय धातु और एक ऑक्सीजन मुक्त एसिड के एक अम्लीय अवशेष द्वारा बनता है। इस मामले में, एक धातु और एक हलोजन बनते हैं। वियोजन समीकरण: CuCl2 → Cu2+ + 2Cl-K (-) Cu2+ + 2e- = Cu0 A (+) 2Cl- - 2e- = Cl20 सारांश समीकरण: Cu2+ + 2Cl- = Cu0 + Cl20 CuCl2 = Cu0 + Cl20 5. विचार करें सोडियम एसीटेट समाधान के इलेक्ट्रोलिसिस की प्रक्रिया करें। CH3COOHa एक सक्रिय धातु और एक कार्बोक्जिलिक एसिड के अम्लीय अवशेषों द्वारा निर्मित नमक है। इलेक्ट्रोलिसिस हाइड्रोजन और क्षार का उत्पादन करता है। वियोजन समीकरण: CH3COONa → CH3COO - + Na+ K (-) 2H2O + 2e- = H20 + 2OH- A (+) 2CH3COO¯- 2e = C2H6 + 2CO2 सारांश समीकरण: 2H2O + 2CH3COO¯ = H20 + 2OH - + C2H6 + 2CO2 2Н2О + 2CH3COONa = 2NaОH + Н20 + C2H6 + 2CO2 6. निकल नाइट्रेट घोल के इलेक्ट्रोलिसिस की प्रक्रिया पर विचार करें। Ni(NO3)2 एक नमक है, जो Mn से H2 तक के वोल्टेज की श्रेणी में एक धातु और एक ऑक्सीजन युक्त एसिड अवशेष द्वारा बनता है। इस प्रक्रिया में हमें धातु, हाइड्रोजन, ऑक्सीजन और अम्ल प्राप्त होते हैं। वियोजन समीकरण: Ni(NO3)2 → Ni2+ + 2NO3- K (-) Ni2+ +2e- = Ni0 2H2O + 2e- = H20 + 2OH- A (+) 2H2O – 4e- = O20 + 4H+ समग्र समीकरण: Ni2+ + 2H2O + 2H2O = Ni0 + H20 + 2OH- + O20 + 4H+ Ni(NO3)2 + 2H2O = Ni0 + 2HNO3 + H20 + O20 7. सल्फ्यूरिक एसिड के घोल के इलेक्ट्रोलिसिस की प्रक्रिया पर विचार करें। वियोजन समीकरण: H2SO4 → 2H+ + SO42- K (-) 2H+ + 2e- = H20 A (+) 2H2O – 4e- = O20 + 4H+ समग्र समीकरण: 2H2O + 4H+ = 2H20 + O20 + 4H+ 2H2O = 2H20 + O20
8. सोडियम हाइड्रॉक्साइड विलयन के इलेक्ट्रोलिसिस की प्रक्रिया पर विचार करें। इस मामले में, केवल पानी इलेक्ट्रोलिसिस होता है। H2SO4, NaNO3, K2SO4, आदि के विलयनों का इलेक्ट्रोलिसिस समान रूप से होता है। पृथक्करण समीकरण: NaOH → Na+ + OH- K (-) 2H2O + 2e- = H20 + 2OH- A (+) 4OH- - 4e- = O20 + 2H2O समग्र समीकरण: 4H2O + 4OH- = 2H20 + 4OH- + O20 + 2H2O 2H2O = 2H20 + O20
घुलनशील इलेक्ट्रोड के साथ इलेक्ट्रोलाइट समाधान के इलेक्ट्रोलिसिस प्रक्रियाओं के उदाहरण
घुलनशील एनोड इलेक्ट्रोलिसिस के दौरान ऑक्सीकरण (विघटन) से गुजरता है। 1. कॉपर एनोड के साथ कॉपर सल्फेट (II) के इलेक्ट्रोलिसिस की प्रक्रिया पर विचार करें। कॉपर एनोड के साथ कॉपर सल्फेट के घोल के इलेक्ट्रोलिसिस के दौरान, आयनों की प्रकृति के बावजूद, कैथोड पर कॉपर की रिहाई और एनोड के क्रमिक विघटन के लिए प्रक्रिया कम हो जाती है। घोल में कॉपर सल्फेट की मात्रा अपरिवर्तित रहती है। वियोजन समीकरण: CuSO4 → Cu2+ + SO42- K (-) Cu2+ +2e- → Cu0 A (+) Cu0 - 2e- → Cu2+ कॉपर आयनों का एनोड से कैथोड में संक्रमण
USE विकल्पों में इस विषय पर कार्यों के उदाहरण
3 बजे। (वार.5)
निष्क्रिय इलेक्ट्रोड पर किसी पदार्थ के सूत्र और उसके जलीय घोल के इलेक्ट्रोलिसिस के उत्पादों के बीच एक पत्राचार स्थापित करें।
पदार्थ इलेक्ट्रोलिसिस उत्पादों का सूत्र
ए) Al2(SO4)3 1. धातु हाइड्रॉक्साइड, एसिड
बी) sOH 2. धातु, हलोजन
सी) एचजी (एनओ 3) 2 3. धातु, ऑक्सीजन
डी) AuBr3 4. हाइड्रोजन, हैलोजन 5. हाइड्रोजन, ऑक्सीजन 6. धातु, अम्ल, ऑक्सीजन तर्क: 1. कैथोड पर Al2(SO4)3 और СsOH के इलेक्ट्रोलिसिस के दौरान, पानी हाइड्रोजन में कम हो जाता है। हम विकल्प 1, 2, 3 और 6 को छोड़ देते हैं। 2. Al2(SO4)3 के लिए, पानी एनोड पर ऑक्सीजन में ऑक्सीकृत हो जाता है। हम विकल्प 5 चुनते हैं। CsOH के लिए, हाइड्रॉक्साइड आयन एनोड पर ऑक्सीजन में ऑक्सीकृत होता है। हम विकल्प 5 चुनते हैं। 3. कैथोड पर Hg(NO3)2 और АuBr3 के इलेक्ट्रोलिसिस के दौरान, धातु के धनायन कम हो जाते हैं। 4. Hg(NO3)2 के लिए, एनोड पर पानी का ऑक्सीकरण होता है। विलयन में नाइट्रेट आयन हाइड्रोजन धनायनों से बंधते हैं, जिससे एनोड स्थान में नाइट्रिक अम्ल बनता है। हम विकल्प 6 चुनते हैं। 5. uBr3 के लिए, Br- आयनों को एनोड पर Br2 में ऑक्सीकृत किया जाता है। हम विकल्प 2 चुनते हैं।
ए
बी
वी
जी
5
5
6
2
3 बजे। (वार.1)
पदार्थ के नाम और उसे प्राप्त करने की विधि के बीच एक पत्राचार स्थापित करें।
इलेक्ट्रोलिसिस द्वारा पदार्थ उत्पादन का नाम ए) लिथियम 1) LiF समाधान बी) फ्लोरीन 2) LiF पिघला हुआ C) चांदी 3) MgCl2 समाधान D) मैग्नीशियम 4) AgNO3 समाधान 5) Ag2O पिघला 6) MgCl2 पिघला तर्क: 1. के समान सोडियम क्लोराइड का इलेक्ट्रोलिसिस पिघल जाता है, लिथियम फ्लोराइड के इलेक्ट्रोलिसिस की प्रक्रिया पिघल जाती है। विकल्प ए और बी के लिए, उत्तर 2 चुनें। 2. चांदी को उसके नमक - सिल्वर नाइट्रेट के घोल से बहाल किया जा सकता है। 3. नमक के घोल से मैग्नीशियम को बहाल नहीं किया जा सकता है। हम विकल्प 6 चुनते हैं - मैग्नीशियम क्लोराइड का एक पिघल।
ए
बी
वी
जी
2
2
4
6
3 बजे। (वार.9)
नमक के सूत्र और इसके जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड पर होने वाली प्रक्रिया के समीकरण के बीच एक पत्राचार स्थापित करें।
कैथोड प्रक्रिया का नमक सूत्र समीकरण
A) Al(NO3)3 1) 2H2O - 4e- → O2 + 4H+
बी) CuCl2 2) 2H2O + 2e- → H2 + 2OH-
C) SbCl3 3) Cu2+ + 1e- → Cu+
डी) Cu(NO3)2 4) Sb3+ - 2 e- → Sb5+ 5) Sb3+ + 3e- → Sb0
6) Cu2+ + 2e- → Cu0
तर्क का क्रम: 1. धातु या जल धनायनों के अपचयन की प्रक्रिया कैथोड पर होती है। इसलिए, हम तुरंत विकल्प 1 और 4 को बाहर कर देते हैं। 2. Al(NO3)3 के लिए: कैथोड पर पानी की कमी की प्रक्रिया चल रही है। विकल्प 2 चुनें। 3. CuCl2 के लिए: Cu2+ धातु के धनायन कम हो जाते हैं। विकल्प 6. चुनें। 4. SbCl3 के लिए: Sb3+ धातु धनायन कम हो गए हैं। विकल्प 5 चुनें। 5. Cu(NO3)2 के लिए: Cu2+ धातु के धनायन कम हो जाते हैं। हम विकल्प 6 चुनते हैं।
ए
बी
वी
जी
2
अपने जलीय घोल के इलेक्ट्रोलिसिस के दौरान नमक के सूत्र और एक अक्रिय एनोड पर बने उत्पाद के बीच एक पत्राचार स्थापित करें: एक पत्र द्वारा इंगित प्रत्येक स्थिति के लिए, एक संख्या द्वारा इंगित संबंधित स्थिति का चयन करें।
| नमक सूत्र | एनोड पर उत्पाद | |
| ए | बी | वी | जी |
समाधान।
एक निष्क्रिय एनोड पर लवण, क्षार और एसिड के जलीय घोल के इलेक्ट्रोलिसिस में:
पानी छोड़ा जाता है और ऑक्सीजन छोड़ा जाता है यदि यह ऑक्सीजन युक्त एसिड का नमक या हाइड्रोफ्लोरिक एसिड का नमक है;
क्षार होने पर हाइड्रॉक्साइड आयनों को छुट्टी दे दी जाती है और ऑक्सीजन छोड़ी जाती है;
एसिड अवशेष जो नमक का हिस्सा है, छुट्टी दे दी जाती है, और यदि यह ऑक्सीजन मुक्त एसिड (को छोड़कर) का नमक है तो संबंधित सरल पदार्थ जारी किया जाता है।
कार्बोक्जिलिक एसिड के लवणों के इलेक्ट्रोलिसिस की प्रक्रिया एक विशेष तरीके से होती है।
उत्तर: 3534।
उत्तर: 3534
स्रोत: यांडेक्स: रसायन विज्ञान में प्रशिक्षण कार्य का उपयोग करें। विकल्प 1।
किसी पदार्थ के सूत्र और उसके जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड पर बने उत्पाद के बीच एक पत्राचार स्थापित करें: एक पत्र द्वारा इंगित प्रत्येक स्थिति के लिए, एक संख्या द्वारा इंगित संबंधित स्थिति का चयन करें।
| पदार्थ सूत्र | इलेक्ट्रोलिसिस उत्पाद, कैथोड में उत्पादित |
|
प्रत्युत्तर में संख्याओं को अक्षरों के अनुरूप क्रम में व्यवस्थित करते हुए लिखिए:
| ए | बी | वी | जी |
समाधान।
लवणों के जलीय विलयनों के इलेक्ट्रोलिसिस के दौरान, कैथोड पर निम्नलिखित छोड़ा जाता है:
हाइड्रोजन, अगर यह धातु का नमक है जो धातु की श्रृंखला में एल्यूमीनियम के बाईं ओर तनाव है;
धातु, अगर यह धातु का नमक है जो हाइड्रोजन के दाईं ओर धातु वोल्टेज की श्रृंखला में है;
धातु और हाइड्रोजन, अगर यह एल्यूमीनियम और हाइड्रोजन के बीच धातु वोल्टेज की श्रृंखला में धातु का नमक है।
उत्तर: 3511.
उत्तर: 3511
स्रोत: यांडेक्स: रसायन विज्ञान में प्रशिक्षण कार्य का उपयोग करें। विकल्प 2।
अपने जलीय घोल के इलेक्ट्रोलिसिस के दौरान नमक के सूत्र और एक अक्रिय एनोड पर बने उत्पाद के बीच एक पत्राचार स्थापित करें: एक पत्र द्वारा इंगित प्रत्येक स्थिति के लिए, एक संख्या द्वारा इंगित संबंधित स्थिति का चयन करें।
| नमक सूत्र | एनोड पर उत्पाद | |
प्रत्युत्तर में संख्याओं को अक्षरों के अनुरूप क्रम में व्यवस्थित करते हुए लिखिए:
| ए | बी | वी | जी |
समाधान।
ऑक्सीजन युक्त एसिड और फ्लोराइड के लवण के जलीय घोल के इलेक्ट्रोलिसिस के दौरान, ऑक्सीजन को पानी से ऑक्सीकृत किया जाता है, इसलिए एनोड पर ऑक्सीजन निकलती है। एनोक्सिक एसिड के जलीय घोल के इलेक्ट्रोलिसिस के दौरान, एसिड अवशेषों का ऑक्सीकरण होता है।
उत्तर: 4436।
उत्तर: 4436
इस पदार्थ के जलीय घोल के इलेक्ट्रोलिसिस के परिणामस्वरूप एक अक्रिय एनोड पर बनने वाले पदार्थ के सूत्र और उत्पाद के बीच एक पत्राचार स्थापित करें: एक पत्र द्वारा इंगित प्रत्येक स्थिति के लिए, एक संख्या द्वारा इंगित संबंधित स्थिति का चयन करें।
| पदार्थ सूत्र | एनोड पर उत्पाद |
2) सल्फर ऑक्साइड (IV) 3) कार्बन मोनोऑक्साइड (IV) 5) ऑक्सीजन 6) नाइट्रिक ऑक्साइड (IV) |
प्रत्युत्तर में संख्याओं को अक्षरों के अनुरूप क्रम में व्यवस्थित करते हुए लिखिए:
| ए | बी | वी | जी |
इलेक्ट्रोलिसिस क्या है? इस प्रश्न के उत्तर की सरल समझ के लिए, आइए प्रत्यक्ष धारा के किसी स्रोत की कल्पना करें। प्रत्येक डीसी स्रोत के लिए, आप हमेशा सकारात्मक और नकारात्मक ध्रुव ढूंढ सकते हैं:
आइए हम इसे दो रासायनिक रूप से प्रतिरोधी विद्युत प्रवाहकीय प्लेटों से जोड़ते हैं, जिन्हें हम इलेक्ट्रोड कहेंगे। सकारात्मक ध्रुव से जुड़ी प्लेट को एनोड कहा जाता है, और नकारात्मक ध्रुव को कैथोड कहा जाता है:
सोडियम क्लोराइड एक इलेक्ट्रोलाइट है; जब यह पिघलता है, तो यह सोडियम केशन और क्लोराइड आयनों में अलग हो जाता है:
NaCl \u003d ना + + सीएल -
जाहिर है, नकारात्मक चार्ज किए गए क्लोरीन आयन सकारात्मक चार्ज इलेक्ट्रोड - एनोड में जाएंगे, और सकारात्मक चार्ज ना + केशन नकारात्मक चार्ज इलेक्ट्रोड - कैथोड में जाएंगे। इसके परिणामस्वरूप, Na + धनायन और Cl-आयन दोनों डिस्चार्ज हो जाएंगे, यानी वे तटस्थ परमाणु बन जाएंगे। डिस्चार्ज Na + आयनों के मामले में इलेक्ट्रॉनों के अधिग्रहण और Cl - आयनों के मामले में इलेक्ट्रॉनों के नुकसान के माध्यम से होता है। अर्थात्, प्रक्रिया कैथोड पर आगे बढ़ती है:
ना + + 1e - = ना 0 ,
और एनोड पर:
सीएल - - 1e - = सीएल
चूंकि प्रत्येक क्लोरीन परमाणु में एक अयुग्मित इलेक्ट्रॉन होता है, उनका एकल अस्तित्व प्रतिकूल होता है और क्लोरीन परमाणु दो क्लोरीन परमाणुओं के अणु में संयोजित होते हैं:
l∙ + Cl \u003d सीएल 2
इस प्रकार, कुल मिलाकर, एनोड पर होने वाली प्रक्रिया इस प्रकार अधिक सही ढंग से लिखी गई है:
2Cl - - 2e - = Cl 2
यानी हमारे पास है:
कैथोड: ना + + 1e - = ना 0
एनोड: 2Cl - - 2e - = Cl 2
आइए इलेक्ट्रॉनिक बैलेंस का योग करें:
ना + + 1e - = ना 0 |∙2
2Cl - - 2e - = Cl 2 |∙1<
दोनों समीकरणों के बाएँ और दाएँ पक्षों को जोड़ें आधी प्रतिक्रिया, हम पाते हैं:
2Na + + 2e - + 2Cl - - 2e - = 2Na 0 + Cl 2
हम दो इलेक्ट्रॉनों को उसी तरह कम करते हैं जैसे बीजगणित में किया जाता है, हमें इलेक्ट्रोलिसिस का आयनिक समीकरण मिलता है:
2NaCl (l.) => 2Na + Cl 2
सैद्धांतिक दृष्टिकोण से, ऊपर माना गया मामला सबसे सरल है, क्योंकि सोडियम क्लोराइड पिघलता है, सकारात्मक रूप से चार्ज किए गए आयनों में केवल सोडियम आयन होते हैं, और नकारात्मक वाले में केवल क्लोरीन आयन होते हैं।
दूसरे शब्दों में, न तो Na + धनायन और न ही Cl - आयनों में कैथोड और एनोड के लिए "प्रतियोगी" थे।
और क्या होगा, उदाहरण के लिए, यदि सोडियम क्लोराइड के पिघलने के बजाय, इसके जलीय घोल से करंट प्रवाहित किया जाता है? इस मामले में सोडियम क्लोराइड का वियोजन भी देखा जाता है, लेकिन जलीय घोल में धात्विक सोडियम का निर्माण असंभव हो जाता है। आखिरकार, हम जानते हैं कि क्षार धातुओं का प्रतिनिधि सोडियम एक अत्यंत सक्रिय धातु है जो पानी के साथ बहुत हिंसक प्रतिक्रिया करता है। यदि ऐसी स्थितियों में सोडियम को कम नहीं किया जा सकता है, तो कैथोड पर क्या कम होगा?
आइए पानी के अणु की संरचना को याद करें। यह एक द्विध्रुव है, अर्थात इसका एक ऋणात्मक और एक धनात्मक ध्रुव है:
यह इस संपत्ति के कारण है कि यह कैथोड सतह और एनोड सतह दोनों को "चारों ओर चिपकाने" में सक्षम है:
निम्नलिखित प्रक्रियाएं हो सकती हैं:
2H 2 O + 2e - \u003d 2OH - + H 2
2H 2 O - 4e - \u003d O 2 + 4H +
इस प्रकार, यह पता चला है कि यदि हम किसी इलेक्ट्रोलाइट के समाधान पर विचार करते हैं, तो हम देखेंगे कि इलेक्ट्रोलाइट के पृथक्करण के दौरान बनने वाले धनायन और आयन कैथोड पर कमी और एनोड पर ऑक्सीकरण के लिए पानी के अणुओं के साथ प्रतिस्पर्धा करते हैं।
तो कैथोड और एनोड पर कौन सी प्रक्रियाएँ होंगी? इलेक्ट्रोलाइट के वियोजन या पानी के अणुओं के ऑक्सीकरण / कमी के दौरान बनने वाले आयनों का निर्वहन? या, शायद, ये सभी प्रक्रियाएँ एक साथ घटित होंगी?
इलेक्ट्रोलाइट के प्रकार के आधार पर, इसके जलीय घोल के इलेक्ट्रोलिसिस के दौरान कई तरह की स्थितियां संभव हैं। उदाहरण के लिए, जलीय वातावरण में क्षार, क्षारीय पृथ्वी धातु, एल्यूमीनियम और मैग्नीशियम के धनायनों को कम नहीं किया जा सकता है, क्योंकि उनकी कमी के परिणामस्वरूप क्रमशः क्षार, क्षारीय पृथ्वी धातु, एल्यूमीनियम या मैग्नीशियम, यानी। धातुएँ जो जल के साथ अभिक्रिया करती हैं।
इस मामले में, कैथोड पर केवल पानी के अणुओं की कमी संभव है।
निम्नलिखित सिद्धांतों का पालन करते हुए किसी भी इलेक्ट्रोलाइट के समाधान के इलेक्ट्रोलिसिस के दौरान कैथोड पर क्या प्रक्रिया होगी, यह याद रखना संभव है:
1) यदि इलेक्ट्रोलाइट में धातु का धनायन होता है, जो सामान्य परिस्थितियों में मुक्त अवस्था में पानी के साथ प्रतिक्रिया करता है, तो कैथोड पर निम्नलिखित प्रक्रिया होती है:
2H 2 O + 2e - \u003d 2OH - + H 2
यह उन धातुओं पर लागू होता है जो अल गतिविधि श्रृंखला की शुरुआत में शामिल हैं।
2) यदि इलेक्ट्रोलाइट में एक धातु का धनायन होता है, जो अपने मुक्त रूप में पानी के साथ प्रतिक्रिया नहीं करता है, लेकिन गैर-ऑक्सीकरण एसिड के साथ प्रतिक्रिया करता है, तो दो प्रक्रियाएं एक साथ होती हैं, दोनों धातु के धनायनों और पानी के अणुओं की कमी:
मैं n+ + ne = मैं 0
इन धातुओं में गतिविधि श्रृंखला में अल और एच के बीच शामिल हैं।
3) यदि इलेक्ट्रोलाइट में हाइड्रोजन केशन (एसिड) या धातु के धनायन होते हैं जो गैर-ऑक्सीकरण एसिड के साथ प्रतिक्रिया नहीं करते हैं, तो केवल इलेक्ट्रोलाइट केशन को बहाल किया जाता है:
2H + + 2e - \u003d H 2 - एसिड के मामले में
Me n + + ne = Me 0 - नमक के मामले में
एनोड पर, इस बीच, स्थिति इस प्रकार है:
1) यदि इलेक्ट्रोलाइट में ऑक्सीजन मुक्त एसिड अवशेष (F - को छोड़कर) के आयन होते हैं, तो उनके ऑक्सीकरण की प्रक्रिया एनोड पर होती है, पानी के अणु ऑक्सीकृत नहीं होते हैं। उदाहरण के लिए:
2Cl - - 2e \u003d Cl 2
एस 2- - 2ई = एस ओ
एनोड पर फ्लोराइड आयनों का ऑक्सीकरण नहीं होता है क्योंकि फ्लोरीन जलीय घोल में नहीं बन पाता है (पानी के साथ प्रतिक्रिया करता है)
2) यदि इलेक्ट्रोलाइट में हाइड्रॉक्साइड आयन (क्षार) होते हैं, तो वे पानी के अणुओं के बजाय ऑक्सीकृत हो जाते हैं:
4OH - - 4e - \u003d 2H 2 O + O 2
3) यदि इलेक्ट्रोलाइट में एनोड पर ऑक्सीजन युक्त एसिड अवशेष (कार्बनिक एसिड अवशेषों को छोड़कर) या फ्लोराइड आयन (एफ -) होता है, तो पानी के अणुओं के ऑक्सीकरण की प्रक्रिया होती है:
2H 2 O - 4e - \u003d O 2 + 4H +
4) एनोड पर एक कार्बोक्जिलिक एसिड के अम्लीय अवशेष के मामले में, निम्नलिखित प्रक्रिया होती है:
2RCOO - - 2e - \u003d R-R + 2CO 2
आइए विभिन्न स्थितियों के लिए इलेक्ट्रोलिसिस समीकरण लिखने का अभ्यास करें:
उदाहरण 1
जस्ता क्लोराइड पिघलने के इलेक्ट्रोलिसिस के दौरान कैथोड और एनोड पर होने वाली प्रक्रियाओं के साथ-साथ सामान्य इलेक्ट्रोलिसिस समीकरण के लिए समीकरण लिखें।
समाधान
जब जिंक क्लोराइड को पिघलाया जाता है, तो यह अलग हो जाता है:
ZnCl 2 \u003d Zn 2+ + 2Cl -
इसके अलावा, इस तथ्य पर ध्यान दिया जाना चाहिए कि यह जस्ता क्लोराइड पिघला हुआ है जो इलेक्ट्रोलिसिस से गुजरता है, न कि जलीय घोल। दूसरे शब्दों में, विकल्पों के बिना, कैथोड पर केवल जिंक केशन की कमी हो सकती है, और एनोड पर क्लोराइड आयनों का ऑक्सीकरण हो सकता है। पानी के अणु नहीं
कैथोड: Zn 2+ + 2e - = Zn 0 |∙1
एनोड: 2Cl - - 2e - = Cl 2 |∙1
ZnCl 2 \u003d Zn + Cl 2
उदाहरण #2
जिंक क्लोराइड के जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड और एनोड पर होने वाली प्रक्रियाओं के साथ-साथ सामान्य इलेक्ट्रोलिसिस समीकरण के लिए समीकरण लिखें।
चूंकि इस मामले में, एक जलीय घोल इलेक्ट्रोलिसिस के अधीन होता है, इसलिए, सैद्धांतिक रूप से, पानी के अणु इलेक्ट्रोलिसिस में भाग ले सकते हैं। चूंकि जिंक अल और एच के बीच गतिविधि श्रृंखला में स्थित है, इसका मतलब है कि कैथोड पर जिंक केशन और पानी के अणुओं की कमी दोनों होगी।
2H 2 O + 2e - \u003d 2OH - + H 2
Zn 2+ + 2e - = Zn 0
क्लोराइड आयन ऑक्सीजन मुक्त एसिड एचसीएल का अम्लीय अवशेष है, इसलिए, एनोड पर ऑक्सीकरण के लिए प्रतिस्पर्धा में, क्लोराइड आयन पानी के अणुओं पर "जीत" करते हैं:
2Cl - - 2e - = Cl 2
इस विशेष मामले में, समग्र इलेक्ट्रोलिसिस समीकरण लिखना असंभव है, क्योंकि कैथोड पर जारी हाइड्रोजन और जस्ता के बीच का अनुपात अज्ञात है।
उदाहरण #3
कॉपर नाइट्रेट के जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड और एनोड पर होने वाली प्रक्रियाओं के साथ-साथ सामान्य इलेक्ट्रोलिसिस समीकरण के लिए समीकरण लिखें।
विलयन में कॉपर नाइट्रेट वियोजित अवस्था में होता है:
Cu(NO 3) 2 \u003d Cu 2+ + 2NO 3 -
कॉपर हाइड्रोजन के दाईं ओर गतिविधि श्रृंखला में है, अर्थात कैथोड पर तांबे के धनायन कम हो जाएंगे:
Cu 2+ + 2e - = Cu 0
नाइट्रेट आयन नंबर 3 - एक ऑक्सीजन युक्त एसिड अवशेष है, जिसका अर्थ है कि एनोड पर ऑक्सीकरण में, नाइट्रेट आयन पानी के अणुओं के साथ प्रतिस्पर्धा में "खो" जाते हैं:
2H 2 O - 4e - \u003d O 2 + 4H +
इस तरह:
कैथोड: Cu 2+ + 2e - = Cu 0 |∙2
2Cu 2+ + 2H 2 O = 2Cu 0 + O 2 + 4H +
जोड़ के परिणामस्वरूप प्राप्त समीकरण इलेक्ट्रोलिसिस का आयनिक समीकरण है। पूर्ण आणविक इलेक्ट्रोलिसिस समीकरण प्राप्त करने के लिए, आपको परिणामी आयनिक समीकरण के बाईं और दाईं ओर 4 नाइट्रेट आयनों को काउंटरों के रूप में जोड़ना होगा। तब हम प्राप्त करेंगे:
2Cu(NO 3) 2 + 2H 2 O = 2Cu 0 + O 2 + 4HNO 3
उदाहरण #4
पोटेशियम एसीटेट के जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड और एनोड पर होने वाली प्रक्रियाओं के साथ-साथ सामान्य इलेक्ट्रोलिसिस समीकरण के लिए समीकरण लिखें।
समाधान:
एक जलीय घोल में पोटेशियम एसीटेट पोटेशियम केशन और एसीटेट आयनों में अलग हो जाता है:
सीएच 3 कुक \u003d सीएच 3 सीओओ - + के +
पोटेशियम एक क्षार धातु है, अर्थात। बहुत शुरुआत में वोल्टेज की विद्युत रासायनिक श्रृंखला में है। इसका अर्थ है कि इसके धनायन कैथोड पर विसर्जित होने में सक्षम नहीं हैं। इसके बजाय, पानी के अणुओं को बहाल किया जाएगा:
2H 2 O + 2e - \u003d 2OH - + H 2
जैसा कि ऊपर उल्लेख किया गया है, कार्बोक्जिलिक एसिड के एसिड अवशेष एनोड पर पानी के अणुओं से ऑक्सीकरण की प्रतियोगिता में "जीत"ते हैं:
2CH 3 सीओओ - - 2e - \u003d सीएच 3 -सीएच 3 + 2CO 2
इस प्रकार, इलेक्ट्रॉनिक संतुलन का योग और कैथोड और एनोड पर अर्ध-प्रतिक्रियाओं के दो समीकरणों को जोड़ने पर, हम प्राप्त करते हैं:
कैथोड: 2H 2 O + 2e - = 2OH - + H 2 |∙1
एनोड: 2CH 3 सीओओ - - 2e - \u003d सीएच 3 -सीएच 3 + 2CO 2 | 1
2H 2 O + 2CH 3 COO - \u003d 2OH - + H 2 + CH 3 -CH 3 + 2CO 2
हमने पूर्ण इलेक्ट्रोलिसिस समीकरण को आयनिक रूप में प्राप्त किया है। समीकरण के बाएँ और दाएँ पक्षों में दो पोटेशियम आयन जोड़ने और उन्हें काउंटरों के साथ जोड़ने पर, हमें आणविक रूप में पूर्ण इलेक्ट्रोलिसिस समीकरण मिलता है:
2H 2 O + 2CH 3 कुक \u003d 2KOH + H 2 + CH 3 -CH 3 + 2CO 2
उदाहरण #5
सल्फ्यूरिक एसिड के जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड और एनोड पर होने वाली प्रक्रियाओं के साथ-साथ सामान्य इलेक्ट्रोलिसिस समीकरण के लिए समीकरण लिखें।
सल्फ्यूरिक एसिड हाइड्रोजन केशन और सल्फेट आयनों में अलग हो जाता है:
एच 2 एसओ 4 \u003d 2 एच + + एसओ 4 2-
कैथोड पर हाइड्रोजन केशन एच + कम हो जाएंगे, और पानी के अणुओं को एनोड पर ऑक्सीकरण किया जाएगा, क्योंकि सल्फेट आयन ऑक्सीजन युक्त एसिड अवशेष हैं:
कैथोड: 2Н + + 2e - = एच 2 |∙2
एनोड: 2H 2 O - 4e - = O 2 + 4H + |∙1
4H + + 2H 2 O \u003d 2H 2 + O 2 + 4H +
समीकरण के बाएँ और दाएँ और बाएँ पक्षों में हाइड्रोजन आयनों को कम करके, हम सल्फ्यूरिक एसिड के जलीय घोल के इलेक्ट्रोलिसिस के लिए समीकरण प्राप्त करते हैं:
2एच 2 ओ \u003d 2एच 2 + ओ 2
जैसा कि देखा जा सकता है, सल्फ्यूरिक एसिड के जलीय घोल का इलेक्ट्रोलिसिस पानी के इलेक्ट्रोलिसिस में कम हो जाता है।
उदाहरण #6
सोडियम हाइड्रॉक्साइड के जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड और एनोड पर होने वाली प्रक्रियाओं के साथ-साथ सामान्य इलेक्ट्रोलिसिस समीकरण के लिए समीकरण लिखें।
सोडियम हाइड्रॉक्साइड का पृथक्करण:
NaOH = Na + + OH -
कैथोड पर केवल पानी के अणु कम हो जाएंगे, क्योंकि सोडियम एक अत्यधिक सक्रिय धातु है, और एनोड पर केवल हाइड्रॉक्साइड आयन हैं:
कैथोड: 2H 2 O + 2e - = 2OH - + H 2 |∙2
एनोड: 4OH - -4e - = O 2 + 2H 2 O |∙1
4H 2 O + 4OH - \u003d 4OH - + 2H 2 + O 2 + 2H 2 O
आइए हम बाएं और दाएं और 4 हाइड्रॉक्साइड आयनों पर दो पानी के अणुओं को कम करें, और हम इस निष्कर्ष पर पहुंचे कि, सल्फ्यूरिक एसिड के मामले में, सोडियम हाइड्रॉक्साइड के जलीय घोल का इलेक्ट्रोलिसिस पानी के इलेक्ट्रोलिसिस में कम हो जाता है।
इलेक्ट्रोलिसिस (ग्रीक इलेक्ट्रान - एम्बर + लिसिस - अपघटन) एक रासायनिक प्रतिक्रिया है जो तब होती है जब एक प्रत्यक्ष धारा एक इलेक्ट्रोलाइट से गुजरती है। यह विद्युत प्रवाह के प्रभाव में पदार्थों का उनके घटक भागों में अपघटन है।
इलेक्ट्रोलिसिस की प्रक्रिया कैथोड (नकारात्मक रूप से चार्ज) के लिए धनायनों (धनात्मक रूप से आवेशित आयनों) की गति है, और ऋणात्मक रूप से आवेशित आयनों (आयनों) से एनोड (सकारात्मक रूप से आवेशित) की ओर है।
तो, आयन और धनायन क्रमशः एनोड और कैथोड की ओर बढ़ते हैं। यहीं पर रासायनिक प्रतिक्रिया होती है। इस विषय पर कार्यों को सफलतापूर्वक हल करने और प्रतिक्रियाओं को लिखने के लिए, कैथोड और एनोड पर प्रक्रियाओं को अलग करना आवश्यक है। इस तरह यह लेख बनाया जाएगा।
कैथोड
धनायन कैथोड की ओर आकर्षित होते हैं - धनावेशित आयन: Na +, K +, Cu 2+, Fe 3+, Ag +, आदि।
कैथोड पर क्या प्रतिक्रिया होती है, यह स्थापित करने के लिए, सबसे पहले, आपको धातु की गतिविधि निर्धारित करने की आवश्यकता है: धातु वोल्टेज की विद्युत रासायनिक श्रृंखला में इसकी स्थिति।

यदि कैथोड पर एक सक्रिय धातु (Li, Na, K) दिखाई देती है, तो इसके बजाय पानी के अणु बहाल हो जाते हैं, जिससे हाइड्रोजन निकलता है। यदि धातु मध्यम गतिविधि (Cr, Fe, Cd) की है, तो हाइड्रोजन और धातु दोनों ही कैथोड पर मुक्त होते हैं। निष्क्रिय धातुओं को कैथोड पर शुद्ध रूप (Cu, Ag) में पृथक किया जाता है।
मैं ध्यान देता हूं कि वोल्टेज की एक श्रृंखला में एल्यूमीनियम को सक्रिय और मध्यम गतिविधि धातुओं के बीच की सीमा माना जाता है। कैथोड पर इलेक्ट्रोलिसिस के दौरान, एल्यूमीनियम (समावेशी!) तक की धातुओं को बहाल नहीं किया जाता है, उनके बजाय, पानी के अणुओं को बहाल किया जाता है - हाइड्रोजन जारी किया जाता है।
इस घटना में कि कैथोड को हाइड्रोजन आयन - एच + की आपूर्ति की जाती है (उदाहरण के लिए, एसिड एचसीएल, एच 2 एसओ 4) के इलेक्ट्रोलिसिस के दौरान, एसिड अणुओं से हाइड्रोजन कम हो जाता है: 2H + - 2e \u003d H 2
एनोड
आयनों को एनोड की ओर आकर्षित किया जाता है - नकारात्मक रूप से चार्ज किए गए आयन: SO 4 2-, PO 4 3-, Cl -, Br -, I -, F -, S 2-, CH 3 COO -।

ऑक्सीजन युक्त आयनों के इलेक्ट्रोलिसिस के दौरान: SO 4 2-, PO 4 3- - एनोड पर आयनों का ऑक्सीकरण नहीं होता है, बल्कि पानी के अणु होते हैं, जिनसे ऑक्सीजन निकलती है।
ऑक्सीजन मुक्त आयनों का ऑक्सीकरण होता है और संबंधित हैलोजन छोड़ते हैं। सल्फर ऑक्सीकरण के ऑक्सीकरण में सल्फाइड आयन। एक अपवाद फ्लोरीन है - यदि यह एनोड से टकराता है, तो पानी के एक अणु को छुट्टी दे दी जाती है और ऑक्सीजन निकलती है। फ्लोरीन सबसे अधिक विद्युत ऋणात्मक तत्व है, और इसलिए यह एक अपवाद है।
कार्बनिक अम्लों के आयनों को एक विशेष तरीके से ऑक्सीकृत किया जाता है: कार्बोक्सिल समूह से सटे रेडिकल को दोगुना कर दिया जाता है, और कार्बोक्सिल समूह (सीओओ) को कार्बन डाइऑक्साइड - सीओ 2 में बदल दिया जाता है।
समाधान उदाहरण
प्रशिक्षण की प्रक्रिया में, आप उन धातुओं से परिचित हो सकते हैं जिन्हें गतिविधि श्रृंखला में छोड़ दिया गया है। प्रशिक्षण चरण में, आप धातु गतिविधि की एक विस्तृत श्रृंखला का उपयोग कर सकते हैं।

अब आपको पता चल जाएगा कि कैथोड पर क्या छोड़ा जाता है ;-)
तो, चलिए अभ्यास करते हैं। आइए जानें कि AgCl, Cu(NO 3) 2 , AlBr 3 , NaF, FeI 2 , CH 3 COOLi के विलयनों के इलेक्ट्रोलिसिस के दौरान कैथोड और एनोड पर क्या बनता है।

कभी-कभी कार्यों में इलेक्ट्रोलिसिस की प्रतिक्रिया को रिकॉर्ड करना आवश्यक होता है। मैं आपको सूचित करता हूं: यदि आप समझते हैं कि कैथोड पर क्या बनता है और एनोड पर क्या होता है, तो प्रतिक्रिया लिखना मुश्किल नहीं है। उदाहरण के लिए, NaCl का इलेक्ट्रोलिसिस लें और प्रतिक्रिया लिखें:
NaCl + H 2 O → H 2 + Cl 2 + NaOH
सोडियम एक सक्रिय धातु है, इसलिए कैथोड पर हाइड्रोजन छोड़ा जाता है। आयन में ऑक्सीजन नहीं होता है, हलोजन - क्लोरीन निकलता है। हम समीकरण लिखते हैं ताकि हम बिना ट्रेस के सोडियम को वाष्पित न कर सकें :) सोडियम पानी के साथ प्रतिक्रिया करके NaOH बनाता है।
आइए CuSO4 के लिए इलेक्ट्रोलिसिस प्रतिक्रिया लिखें:
CuSO 4 + H 2 O → Cu + O 2 + H 2 SO 4
कॉपर कम सक्रिय धातुओं से संबंधित है, इसलिए, अपने शुद्ध रूप में, इसे कैथोड पर छोड़ा जाता है। आयन ऑक्सीजन युक्त होता है, इसलिए प्रतिक्रिया में ऑक्सीजन निकलती है। सल्फेट आयन कहीं गायब नहीं होता है, यह पानी के हाइड्रोजन के साथ मिलकर सल्फ्यूरिक एसिड में बदल जाता है।
इलेक्ट्रोलिसिस पिघलाएं
इस बिंदु तक हमने जो कुछ भी चर्चा की है वह उन समाधानों के इलेक्ट्रोलिसिस के बारे में है जहां विलायक पानी है।
धातुओं (पदार्थों) को शुद्ध रूप में प्राप्त करने के लिए - औद्योगिक रसायन विज्ञान एक महत्वपूर्ण कार्य का सामना करता है। निष्क्रिय धातुओं (Ag, Cu) को विलयनों के इलेक्ट्रोलिसिस द्वारा आसानी से प्राप्त किया जा सकता है।
लेकिन सक्रिय धातुओं के बारे में क्या: ना, के, ली? आखिरकार, उनके समाधानों के इलेक्ट्रोलिसिस के दौरान, वे कैथोड पर अपने शुद्ध रूप में नहीं निकलते हैं, इसके बजाय, पानी के अणु कम हो जाते हैं और हाइड्रोजन जारी होता है। यह वह जगह है जहां पिघला देता है जिसमें पानी नहीं होता है।

निर्जल मेल्ट में, प्रतिक्रियाएं और भी सरल रूप से लिखी जाती हैं: पदार्थ अपने घटक भागों में टूट जाते हैं:
AlCl 3 → Al + Cl 2
LiBr → ली + Br2
© बेलेविच यूरी सर्गेइविच 2018-2020
यह लेख यूरी सर्गेइविच बेलेविच द्वारा लिखा गया था और यह उनकी बौद्धिक संपदा है। कॉपीराइट धारक की पूर्व सहमति के बिना प्रतिलिपि बनाना, वितरण करना (इंटरनेट पर अन्य साइटों और संसाधनों की प्रतिलिपि बनाना सहित) या सूचना और वस्तुओं का कोई अन्य उपयोग कानून द्वारा दंडनीय है। लेख की सामग्री और उनका उपयोग करने की अनुमति प्राप्त करने के लिए, कृपया संपर्क करें
पीछे की ओर आगे की ओर
ध्यान! स्लाइड पूर्वावलोकन केवल सूचना के उद्देश्यों के लिए है और प्रस्तुति की पूरी सीमा का प्रतिनिधित्व नहीं कर सकता है। यदि आप इस काम में रुचि रखते हैं, तो कृपया पूर्ण संस्करण डाउनलोड करें।
USE के परिणाम बताते हैं कि "इलेक्ट्रोलिसिस" विषय पर कार्य स्नातकों के लिए कठिन बने हुए हैं। स्कूल के पाठ्यक्रम में, इस विषय के अध्ययन के लिए अपर्याप्त संख्या में घंटे आवंटित किए जाते हैं। इसलिए, छात्रों को परीक्षा के लिए तैयार करते समय, इस मुद्दे का बहुत विस्तार से अध्ययन करना आवश्यक है। इलेक्ट्रोकैमिस्ट्री की मूल बातें जानने से स्नातक को सफलतापूर्वक परीक्षा उत्तीर्ण करने और उच्च शिक्षण संस्थान में अपनी शिक्षा जारी रखने में मदद मिलेगी। पर्याप्त स्तर पर "इलेक्ट्रोलिसिस" विषय का अध्ययन करने के लिए, परीक्षा उत्तीर्ण करने वाले स्नातकों के साथ प्रारंभिक कार्य करना आवश्यक है : - "इलेक्ट्रोलिसिस" विषय में बुनियादी अवधारणाओं की परिभाषाओं पर विचार करें; - इलेक्ट्रोलिसिस पिघलने और इलेक्ट्रोलाइट्स के समाधान की प्रक्रिया का विश्लेषण करें; - कैथोड पर धनायनों की कमी और एनोड पर आयनों के ऑक्सीकरण के लिए नियमों को ठीक करें ( समाधान के इलेक्ट्रोलिसिस के दौरान पानी के अणुओं की भूमिका); - इलेक्ट्रोलिसिस प्रक्रिया (कैथोड और एनोड प्रक्रियाओं) के लिए समीकरण तैयार करने के लिए कौशल का निर्माण; - छात्रों को बुनियादी स्तर (कार्य), उच्च और उच्च स्तर के मानक कार्यों को करने के लिए सिखाना जटिलता का। इलेक्ट्रोलीज़- एक प्रत्यक्ष विद्युत प्रवाह के पारित होने के साथ इलेक्ट्रोलाइट्स के समाधान और पिघलने में होने वाली रेडॉक्स प्रक्रिया। इलेक्ट्रोलाइट के घोल या पिघल में, यह आयनों में वियोजित हो जाता है। जब विद्युत प्रवाह चालू होता है, तो आयन एक निर्देशित गति प्राप्त करते हैं, और इलेक्ट्रोड की सतह पर रेडॉक्स प्रक्रियाएं हो सकती हैं। एनोड- उस पर एक सकारात्मक इलेक्ट्रोड, ऑक्सीकरण प्रक्रियाएं हो रही हैं।
कैथोड एक नकारात्मक इलेक्ट्रोड है, उस पर पुनर्प्राप्ति प्रक्रियाएं हो रही हैं।
इलेक्ट्रोलिसिस पिघलाएंएल्युमिनियम (समावेशी) तक वोल्टेज की एक श्रृंखला में स्थित सक्रिय धातुओं को प्राप्त करने के लिए उपयोग किया जाता है।
सोडियम क्लोराइड का इलेक्ट्रोलिसिस पिघलता है
के (-) ना + + 1e -> ना 0
ए (+) 2Cl - - 2e -> Cl 2 0
2NaCl (इलेक्ट्रॉनिक करंट) -> 2Na + Cl 2 (केवल पिघले इलेक्ट्रोलिसिस के लिए)।
एल्युमिनियम गलित क्रायोलाइट (Na 3 AlF 6) में एल्युमिनियम ऑक्साइड के विलयन के इलेक्ट्रोलिसिस द्वारा प्राप्त किया जाता है।
2Al 2 O 3 (इलेक्ट्रॉनिक करंट) -> 4Al + 3O 2
के (-) अल 3+ +3e‾ -> अल
ए(+)2O 2‾ -2e‾ ->O 2
पोटेशियम हाइड्रॉक्साइड के पिघलने का इलेक्ट्रोलिसिस।
कोह-> के + + ओएच‾
के (-) के + + 1e -> के 0
ए (+) 4OH - - 4e -> O 2 0 + 2H 2 O
4KOH (विद्युत प्रवाह) -> 4K 0 + O 2 0 + 2H 2 O
जलीय घोलों का इलेक्ट्रोलिसिस अधिक कठिन होता है, क्योंकि इस मामले में पानी के अणुओं को इलेक्ट्रोड पर कम या ऑक्सीकृत किया जा सकता है।
लवणों के जलीय विलयनों का इलेक्ट्रोलिसिसइलेक्ट्रोड प्रक्रियाओं में कैथोड और एनोड पर पानी के अणुओं की संभावित भागीदारी के कारण अधिक जटिल है।
जलीय घोल में इलेक्ट्रोलिसिस के नियम।
कैथोड पर:
1. लिथियम से एल्युमिनियम (समावेशी) तक धातु वोल्टेज की एक श्रृंखला में स्थित उद्धरण, साथ ही साथ उद्धरण एनएच 4 +बहाल नहीं होते हैं, इसके बजाय पानी के अणुओं को बहाल किया जाता है:
2एच 2 ओ + 2ई->एच 2 + 2 ओएच -
2. एल्युमिनियम से हाइड्रोजन के बाद वोल्टेज की श्रृंखला में स्थित धनायनों को पानी के अणुओं के साथ मिलकर कम किया जा सकता है:
2एच 2 ओ + 2ई->एच 2 + 2 ओएच -
Zn2+ + 2e->Zn 0
3. हाइड्रोजन पूरी तरह से बहाल होने के बाद वोल्टेज की एक श्रृंखला में स्थित उद्धरण: एजी + + 1e->एजी 0
4. अम्ल विलयनों में हाइड्रोजन आयन अपचित होते हैं: 2H + + 2e->एच 2
एनोड पर:
1. ऑक्सीजन युक्त आयन और एफ-- ऑक्सीकरण न करें, उनके बजाय पानी के अणु ऑक्सीकृत होते हैं:
2एच 2 ओ - 4e->ओ 2 + 4 एच +
2. सल्फर, आयोडीन, ब्रोमीन, क्लोरीन (इस क्रम में) के आयनों को सरल पदार्थों में ऑक्सीकृत किया जाता है:
2Cl - - 2e->क्लोरीन 2 0 एस 2- - 2e->S0
3. क्षार विलयन में हाइड्रॉक्साइड आयन ऑक्सीकृत होते हैं:
4OH - - 4e->ओ 2 + 2 एच 2 ओ
4. कार्बोक्जिलिक एसिड के लवण के घोल में आयनों का ऑक्सीकरण होता है:
2 आर - एसओओ - - 2e->आर - आर + 2CO 2
5. घुलनशील एनोड का उपयोग करते समय, एनोड स्वयं धातु के परमाणुओं के ऑक्सीकरण के कारण बाहरी सर्किट में इलेक्ट्रॉनों को भेजता है जिससे एनोड बनता है:
घन 0 - 2e->यू 2+
जलीय इलेक्ट्रोलाइट समाधान में इलेक्ट्रोलिसिस प्रक्रियाओं के उदाहरण
उदाहरण 1के 2 एसओ 4 -> 2 के + + एसओ 4 2-
K(-)2H 2 O + 2e‾ -> H 2 + 2OH -
ए (+) 2 एच 2 ओ - 4 ई‾ -> ओ 2 + 4 एच +
इलेक्ट्रोलिसिस का सामान्य समीकरण: 2H 2 O (el। करंट) -> 2 H 2 + O 2
उदाहरण 2. NaCl -> Na + +Cl‾
K(-)2H 2 O + 2e‾ -> H 2 + 2OH -
ए (+) 2Cl - - 2e -> Cl 2 0
2NaCl + 2H 2 O (ईल करंट) -> H 2 + 2NaOH + Cl 2
उदाहरण 3. Cu SO 4 -> Cu 2+ + SO 4 2-
K(-) Cu 2+ + 2e‾ -> Cu
ए (+) 2 एच 2 ओ - 4 ई‾ -> ओ 2 + 4 एच +
सामान्य इलेक्ट्रोलिसिस समीकरण: 2 Cu SO 4 + 2H 2 O (EL. करंट) -> 2Cu + O 2 + 2H 2 SO 4
उदाहरण 4. CH 3 COONa->CH 3 COO‾ +Na +
K(-)2H 2 O + 2e‾ -> H 2 + 2OH -
A(+)2CH 3 COO‾– 2e‾ ->C 2 H 6 +2CO 2
सामान्य इलेक्ट्रोलिसिस समीकरण:
सीएच 3 कूना + 2एच 2 ओ (ई. वर्तमान) -> एच 2 + 2नाहको 3 + सी 2 एच 6
जटिलता के बुनियादी स्तर के कार्य
विषय पर परीक्षण "पिघल का इलेक्ट्रोलिसिस और लवण का समाधान। धातुओं के तनाव की एक श्रृंखला ”।
1. क्षार जलीय घोल में इलेक्ट्रोलिसिस के उत्पादों में से एक है:
1) केसीआई 2) CuSO 4 3) FeCI 2 4) AgNO 3
2. पोटेशियम नाइट्रेट के जलीय घोल के इलेक्ट्रोलिसिस के दौरान, एनोड पर निम्नलिखित छोड़ा जाता है: 1) लगभग 2 2) NO 2 3) N 2 4) H 23. जलीय विलयन के इलेक्ट्रोलिसिस के दौरान हाइड्रोजन बनता है: 1) सीएसीआई 2 2) CuSO 4 3) Hg (NO 3) 2 4) AgNO 34. प्रतिक्रिया संभव है: 1) Ag और K 2 SO 4 (समाधान) 2) Zn और KCI (समाधान) 3) एमजी और एसएनसीआई 2(समाधान) 4) Ag और CuSO4 (समाधान) 5. कैथोड पर सोडियम आयोडाइड के घोल के इलेक्ट्रोलिसिस के दौरान, घोल में लिटमस का रंग: 1) लाल 2 ) नीला 3) बैंगनी 4) पीला6। पोटेशियम फ्लोराइड के जलीय घोल के इलेक्ट्रोलिसिस के दौरान, कैथोड पर निम्नलिखित छोड़ा जाता है: 1) हाइड्रोजन 2) हाइड्रोजन फ्लोराइड 3) फ्लोरीन 4) ऑक्सीजन
"इलेक्ट्रोलिसिस" विषय पर कार्य
1. जब कैथोड पर 11.2 लीटर (no.) गैस छोड़ी गई, तो 20% सामान्य नमक के घोल के 400 ग्राम के इलेक्ट्रोलिसिस को रोक दिया गया। मूल नमक के अपघटन की डिग्री (% में) है:
1) 73 2) 54,8 3) 36,8 4) 18
समस्या का समाधान।हम इलेक्ट्रोलिसिस प्रतिक्रिया समीकरण की रचना करते हैं: 2NaCl + 2H 2 O → H 2 + Cl 2 + 2NaOHm (NaCl) \u003d 400 0.2 \u003d 80 ग्राम नमक घोल में था। ν (H 2) \u003d 11.2 / 22.4 \u003d 0 .5 mol (NaCl)=0.5∙2=1 mol(NaCl)= 1∙58.5=58.5 ग्राम नमक इलेक्ट्रोलिसिस के दौरान विघटित हो गया था। नमक अपघटन की डिग्री 58.5/80 = 0.73 या 73%।उत्तर: 73% नमक विघटित हो गया है।
2. क्रोमियम (III) सल्फेट के 10% घोल के 200 ग्राम का इलेक्ट्रोलिसिस तब तक किया जाता है जब तक कि नमक पूरी तरह से खत्म न हो जाए (धातु कैथोड पर निकल जाए)। उपयोग किए गए पानी का द्रव्यमान (ग्राम में) है:
1) 0,92 2) 1,38 3) 2,76 4) 5,52
समस्या का समाधान।हम इलेक्ट्रोलिसिस प्रतिक्रिया समीकरण की रचना करते हैं: 2Cr 2 (SO 4) 3 + 6H 2 O → 4Cr + 3O 2 + 6H 2 SO 4m (Cr 2 (SO 4) 3) \u003d 200 0.1 \u003d 20g (Cr 2 () SO 4) 3) \u003d 20 / 392 \u003d 0.051 mol (H 2 O) \u003d 0.051 3 \u003d 0.153 mol (H 2 O) \u003d 0.153 18 \u003d 2.76 gजटिलता के बढ़े हुए स्तर के कार्य B3
1. नमक के सूत्र और उसके जलीय घोल के इलेक्ट्रोलिसिस के दौरान एनोड पर होने वाली प्रक्रिया के समीकरण के बीच एक पत्राचार स्थापित करें।
3. नमक के सूत्र और इसके जलीय घोल के इलेक्ट्रोलिसिस के दौरान कैथोड पर होने वाली प्रक्रिया के समीकरण के बीच एक पत्राचार स्थापित करें।
5. पदार्थ के नाम और उसके जलीय विलयन के इलेक्ट्रोलिसिस उत्पादों के बीच एक पत्राचार स्थापित करें।
जवाब: 1 - 3411, 2 - 3653, 3 - 2353, 4 - 2246, 5 - 145। इस प्रकार, इलेक्ट्रोलिसिस के विषय का अध्ययन करते हुए, स्नातक इस खंड में अच्छी तरह से महारत हासिल करते हैं और परीक्षा में अच्छे परिणाम दिखाते हैं। सामग्री का अध्ययन इस विषय पर एक प्रस्तुति के साथ है।