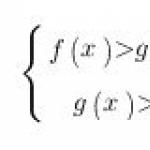Argomento 6. "Elettrolisi di soluzioni e sale si scioglie"
1. L'elettrolisi è un processo redox che si verifica sugli elettrodi quando una corrente elettrica viene fatta passare attraverso una soluzione elettrolitica o si scioglie.
2. Catodo - elettrodo caricato negativamente. Vi è una riduzione dei metalli e dei cationi idrogeno (in acidi) o delle molecole d'acqua.
3. Anodo: un elettrodo caricato positivamente. Si verifica l'ossidazione degli anioni del residuo acido e del gruppo ossidrile (in alcali).
4. Durante l'elettrolisi di una soluzione salina, nella miscela di reazione è presente acqua. Poiché l'acqua può presentare proprietà sia ossidanti che riducenti, è un "concorrente" sia per i processi catodici che anodici.
5. Esistono elettrolisi con elettrodi inerti (grafite, carbonio, platino) e un anodo attivo (solubile), nonché elettrolisi di fusi e soluzioni di elettroliti.
PROCESSI CATODICI
Se il metallo è in una serie di tensioni:
La posizione del metallo in una serie di sollecitazioni
Recupero al catodo
da Li ad Al
Le molecole d'acqua sono ridotte: 2H2O + 2e- → H20+ 2OH-
Mn a Pb
Sia le molecole d'acqua che i cationi metallici vengono ripristinati:
2H2O + 2e- → H20+ 2OH-
Uomini+ + ne- → Io0
da Cu ad Au
I cationi metallici sono ridotti: Men+ + ne- → Me0
PROCESSI ANODICI
residuo acido
Asm-
Anodo
Solubile
(ferro, zinco, rame, argento)
Insolubile
(grafite, oro, platino)
anossico
Ossidazione anodica del metallo
М0 – ne- = Mn+
soluzione anodica
Ossidazione anionica (tranne F-)
Acm- - me- = Ac0
Contenente ossigeno
Fluoro - ione (F-)
In ambienti acidi e neutri:
2 H2O - 4e- → O20 + 4H+
In ambiente alcalino:
4OH- - 4e- \u003d O20 + 2H2O
Esempi di processi di elettrolisi fusa con elettrodi inerti
Nella fusione dell'elettrolita sono presenti solo i suoi ioni, quindi i cationi dell'elettrolita vengono ridotti al catodo e gli anioni vengono ossidati all'anodo.
1. Considera l'elettrolisi di un fuso di cloruro di potassio.
Dissociazione termica KCl → K+ + Cl-
K(-) K+ + 1e- → K0
A (+) 2Cl- - 2e- → Cl02
Equazione riepilogativa:
2KCl → 2K0 + Cl20
2. Considerare l'elettrolisi di un fuso di cloruro di calcio.
Dissociazione termica CaCl2 → Ca2+ + 2Cl-
K(-) Ca2+ + 2e- → Ca0
A (+) 2Cl- - 2e- → Cl02
Equazione riepilogativa:
CaCl2 → Ca0 + Cl20
3. Considera l'elettrolisi di una fusione di idrossido di potassio.
Dissociazione termica di KOH → K+ + OH-
K(-) K+ + 1e- → K0
A (+) 4OH- - 4e- → O20 + 2H2O
Equazione riepilogativa:
4KOH → 4K0 + O20 + 2H2O
Esempi di processi di elettrolisi di soluzioni elettrolitiche con elettrodi inerti
A differenza dei fusi, in una soluzione elettrolitica, oltre ai suoi ioni, ci sono molecole d'acqua. Pertanto, quando si considerano i processi sugli elettrodi, è necessario tenere conto della loro partecipazione. L'elettrolisi di una soluzione salina formata da un metallo attivo, che sta in una serie di tensioni fino all'alluminio e un residuo acido di un acido contenente ossigeno, si riduce all'elettrolisi dell'acqua. 1. Considera l'elettrolisi di una soluzione acquosa di solfato di magnesio. MgSO4 è un sale formato da un metallo che sta in una serie di sollecitazioni fino all'alluminio e da un residuo acido contenente ossigeno. Equazione di dissociazione: MgSO4 → Mg2+ + SO42- K (-) 2H2O + 2e- \u003d H20 + 2OH- A (+) 2H2O - 4e- \u003d O20 + 4H + Equazione totale: 6H2O \u003d 2H20 + 4OH- + O20 + 4H + 2H2O \u003d 2H20 + O20 2. Considera l'elettrolisi di una soluzione acquosa di solfato di rame (II). СuSO4 è un sale formato da un metallo poco attivo e da un residuo acido contenente ossigeno. In questo caso, l'elettrolisi produce metallo, ossigeno e l'acido corrispondente si forma nello spazio catodo-anodo. Equazione di dissociazione: CuSO4 → Cu2+ + SO42- K (-) Cu2+ + 2e- = Cu0 A (+) 2H2O – 4e- = O20 + 4H+ Equazione di sintesi: 2Cu2+ + 2H2O = 2Cu0 + O20 + 4H+ 2CuSO4 + 2H2O = 2Cu0 + О20 + 2Н2SO4
3. Considerare l'elettrolisi di una soluzione acquosa di cloruro di calcio. CaCl2 è un sale formato da un metallo attivo e da un residuo acido privo di ossigeno. In questo caso, durante l'elettrolisi si formano idrogeno, alogeno e nello spazio catodo-anodo si formano alcali. Equazione di dissociazione: CaCl2 → Ca2+ + 2Cl- K (-) 2H2O + 2e- = H20 + 2OH- A (+) 2Cl- – 2e- = Cl20 Equazione di sintesi: 2H2O + 2Cl- = Cl20 + 2OH- CaCl2 + 2H2O = Ca (OH)2 + Cl20 + H20 4. Considerare l'elettrolisi di una soluzione acquosa di cloruro di rame (II). CuCl2 è un sale formato da un metallo poco attivo e da un residuo acido di un acido privo di ossigeno. In questo caso si formano un metallo e un alogeno. Equazione di dissociazione: CuCl2 → Cu2+ + 2Cl- K (-) Cu2+ + 2e- = Cu0 A (+) 2Cl- – 2e- = Cl20 Equazione riepilogativa: Cu2+ + 2Cl- = Cu0 + Cl20 CuCl2 = Cu0 + Cl20 5. Considerare il elettrolisi di processo della soluzione di acetato di sodio. CH3COOHa è un sale formato dal metallo attivo e dal residuo acido di un acido carbossilico. L'elettrolisi produce idrogeno e alcali. Equazione di dissociazione: CH3COONa → CH3COO - + Na+ K (-) 2H2O + 2e- = H20 + 2OH- A (+) 2CH3COO¯- 2e = C2H6 + 2CO2 Equazione di sintesi: 2H2O + 2CH3COO¯ = H20 + 2OH - + C2H6 + 2CO2 2Н2О + 2CH3COONa = 2NaОH + Н20 + C2H6 + 2CO2 6. Considera il processo di elettrolisi della soluzione di nitrato di nichel. Ni(NO3)2 è un sale, che è formato da un metallo nell'intervallo di tensioni da Mn a H2 e un residuo acido contenente ossigeno. Nel processo, otteniamo metallo, idrogeno, ossigeno e acido. Equazione di dissociazione: Ni(NO3)2 → Ni2+ + 2NO3- K (-) Ni2+ +2e- = Ni0 2H2O + 2e- = H20 + 2OH- A (+) 2H2O – 4e- = O20 + 4H+ Equazione generale: Ni2+ + 2H2O + 2H2O = Ni0 + H20 + 2OH- + O20 + 4H+ Ni(NO3)2 + 2H2O = Ni0 + 2HNO3 + H20 + O20 7. Considerare il processo di elettrolisi di una soluzione di acido solforico. Equazione di dissociazione: H2SO4 → 2H+ + SO42- K (-) 2H+ + 2e- = H20 A (+) 2H2O – 4e- = O20 + 4H+ Equazione complessiva: 2H2O + 4H+ = 2H20 + O20 + 4H+ 2H2O = 2H20 + O20
8. Considerare il processo di elettrolisi della soluzione di idrossido di sodio. In questo caso avviene solo l'elettrolisi dell'acqua. L'elettrolisi di soluzioni di H2SO4, NaNO3, K2SO4, ecc.. Equazione di dissociazione: NaOH → Na+ + OH- K (-) 2H2O + 2e- = H20 + 2OH- A (+) 4OH- – 4e- = O20 + 2H2O Equazione complessiva: 4H2O + 4OH- = 2H20 + 4OH- + O20 + 2H2O 2H2O = 2H20 + O20
Esempi di processi di elettrolisi di soluzioni elettrolitiche con elettrodi solubili
L'anodo solubile subisce ossidazione (dissoluzione) durante l'elettrolisi. 1. Considera il processo di elettrolisi del solfato di rame (II) con un anodo di rame. Durante l'elettrolisi di una soluzione di solfato di rame con un anodo di rame, il processo si riduce al rilascio di rame al catodo e alla graduale dissoluzione dell'anodo, nonostante la natura dell'anione. La quantità di solfato di rame in soluzione rimane invariata. Equazione di dissociazione: CuSO4 → Cu2+ + SO42- K (-) Cu2+ +2e- → Cu0 A (+) Cu0 - 2e- → Cu2+ transizione degli ioni rame dall'anodo al catodo
Esempi di attività su questo argomento nelle opzioni USE
ALLE 3. (Var.5)
Stabilire una corrispondenza tra la formula di una sostanza ei prodotti dell'elettrolisi della sua soluzione acquosa su elettrodi inerti.
FORMULA DELLA SOSTANZA PRODOTTI ELETTROLISI
A) Al2(SO4)3 1. idrossido di metallo, acido
B) СsOH 2. metallo, alogeno
C) Hg(NO3)2 3. metallo, ossigeno
D) AuBr3 4. idrogeno, alogeno 5. idrogeno, ossigeno 6. metallo, acido, ossigeno Argomento: 1. Durante l'elettrolisi di Al2(SO4)3 e СsOH sul catodo, l'acqua viene ridotta a idrogeno. Escludiamo le opzioni 1, 2, 3 e 6. 2. Per Al2(SO4)3, l'acqua viene ossidata in ossigeno all'anodo. Scegliamo l'opzione 5. Per CsOH, lo ione idrossido viene ossidato in ossigeno all'anodo. Scegliamo l'opzione 5. 3. Durante l'elettrolisi di Hg(NO3)2 e АuBr3 sul catodo, i cationi metallici vengono ridotti. 4. Per Hg(NO3)2, l'acqua viene ossidata all'anodo. Gli ioni nitrato in soluzione si legano ai cationi idrogeno, formando acido nitrico nello spazio dell'anodo. Scegliamo l'opzione 6. 5. Per АuBr3, il Branione viene ossidato all'anodo a Br2. Scegliamo l'opzione 2.
UN
B
V
G
5
5
6
2
ALLE 3. (Var.1)
Stabilire una corrispondenza tra il nome della sostanza e il metodo per ottenerla.
DENOMINAZIONE DELLA SOSTANZA PRODUZIONE PER ELETTROLISI A) litio 1) soluzione LiF B) fluoro 2) fusione LiF C) argento 3) soluzione MgCl2 D) magnesio 4) soluzione AgNO3 5) fusione Ag2O 6) fusione MgCl2 Argomento: 1. Simile al elettrolisi della fusione del cloruro di sodio, procede il processo di elettrolisi della fusione del fluoruro di litio. Per le opzioni A e B, scegli le risposte 2. 2. L'argento può essere ripristinato da una soluzione del suo sale - nitrato d'argento. 3. Il magnesio non può essere ripristinato da una soluzione salina. Scegliamo l'opzione 6: una fusione di cloruro di magnesio.
UN
B
V
G
2
2
4
6
ALLE 3. (Var.9)
Stabilire una corrispondenza tra la formula del sale e l'equazione del processo che si verifica sul catodo durante l'elettrolisi della sua soluzione acquosa.
EQUAZIONE DELLA FORMULA DEL SALE DEL PROCESSO CATODICO
A) Al(NO3)3 1) 2H2O – 4e- → O2 + 4H+
B) CuCl2 2) 2H2O + 2e- → H2 + 2OH-
C) SbCl3 3) Cu2+ + 1e- → Cu+
D) Cu(NO3)2 4) Sb3+ - 2 e- → Sb5+ 5) Sb3+ + 3e- → Sb0
6) Cu2+ + 2e- → Cu0
Il corso del ragionamento: 1. Sul catodo avvengono processi di riduzione di cationi metallici o acqua. Escludiamo quindi immediatamente le opzioni 1 e 4. 2. Per Al(NO3)3: al catodo è in corso il processo di riduzione dell'acqua. Scegliere l'opzione 2. 3. Per CuCl2: i cationi metallici Cu2+ sono ridotti. Scegliere l'opzione 6. 4. Per SbCl3: i cationi metallici Sb3+ sono ridotti. Selezionare l'opzione 5. 5. Per Cu(NO3)2: i cationi metallici Cu2+ sono ridotti. Scegliamo l'opzione 6.
UN
B
V
G
2
Stabilire una corrispondenza tra la formula del sale e il prodotto formatosi su un anodo inerte durante l'elettrolisi della sua soluzione acquosa: per ogni posizione indicata da una lettera, selezionare la posizione corrispondente indicata da un numero.
| FORMULA DI SALE | PRODOTTO SU ANODO | |
| UN | B | V | G |
Soluzione.
Nell'elettrolisi di soluzioni acquose di sali, alcali e acidi su anodo inerte:
L'acqua viene scaricata e viene rilasciato ossigeno se è un sale di un acido contenente ossigeno o un sale di acido fluoridrico;
Gli ioni idrossido vengono scaricati e l'ossigeno viene rilasciato se è alcalino;
Il residuo acido che fa parte del sale viene scaricato e la sostanza semplice corrispondente viene rilasciata se è un sale di un acido privo di ossigeno (tranne).
Il processo di elettrolisi dei sali degli acidi carbossilici avviene in modo speciale.
Risposta: 3534.
Risposta: 3534
Fonte: Yandex: USE lavoro di formazione in chimica. Opzione 1.
Stabilire una corrispondenza tra la formula di una sostanza e il prodotto formato sul catodo durante l'elettrolisi della sua soluzione acquosa: per ogni posizione indicata da una lettera, selezionare la posizione corrispondente indicata da un numero.
| FORMULA DELLA SOSTANZA | PRODOTTO ELETTROLISI, PRODOTTO AL CATODO |
|
Annota i numeri in risposta, disponendoli nell'ordine corrispondente alle lettere:
| UN | B | V | G |
Soluzione.
Durante l'elettrolisi di soluzioni acquose di sali, al catodo viene rilasciato:
Idrogeno, se è un sale di un metallo che si trova nella serie di sollecitazioni metalliche a sinistra dell'alluminio;
Metallo, se è un sale di un metallo che si trova nella serie di tensioni metalliche a destra dell'idrogeno;
Metallo e idrogeno, se è un sale di un metallo nella serie di tensioni metalliche tra alluminio e idrogeno.
Risposta: 3511.
Risposta: 3511
Fonte: Yandex: USE lavoro di formazione in chimica. Opzione 2.
Stabilire una corrispondenza tra la formula del sale e il prodotto formatosi su un anodo inerte durante l'elettrolisi della sua soluzione acquosa: per ogni posizione indicata da una lettera, selezionare la posizione corrispondente indicata da un numero.
| FORMULA DI SALE | PRODOTTO SU ANODO | |
Annota i numeri in risposta, disponendoli nell'ordine corrispondente alle lettere:
| UN | B | V | G |
Soluzione.
Durante l'elettrolisi di soluzioni acquose di sali di acidi e fluoruri contenenti ossigeno, l'ossigeno viene ossidato dall'acqua, quindi l'ossigeno viene rilasciato nell'anodo. Durante l'elettrolisi di soluzioni acquose di acidi anossici, il residuo acido viene ossidato.
Risposta: 4436.
Risposta: 4436
Stabilire una corrispondenza tra la formula di una sostanza e il prodotto che si forma su un anodo inerte a seguito dell'elettrolisi di una soluzione acquosa di tale sostanza: per ogni posizione indicata da una lettera, selezionare la posizione corrispondente indicata da un numero.
| FORMULA DELLA SOSTANZA | PRODOTTO SU ANODO |
2) ossido di zolfo (IV) 3) monossido di carbonio (IV) 5) ossigeno 6) ossido nitrico (IV) |
Annota i numeri in risposta, disponendoli nell'ordine corrispondente alle lettere:
| UN | B | V | G |
Cos'è l'elettrolisi? Per una comprensione più semplice della risposta a questa domanda, immaginiamo qualsiasi fonte di corrente continua. Per ogni sorgente DC puoi sempre trovare un polo positivo e uno negativo:
Colleghiamo ad esso due piastre elettricamente conduttive chimicamente resistenti, che chiameremo elettrodi. La piastra collegata al polo positivo si chiama anodo e al polo negativo si chiama catodo:
Il cloruro di sodio è un elettrolita; quando si scioglie, si dissocia in cationi di sodio e ioni cloruro:
NaCl \u003d Na + + Cl -
Ovviamente, gli anioni di cloro caricati negativamente andranno all'elettrodo caricato positivamente - l'anodo, e i cationi Na + caricati positivamente andranno all'elettrodo caricato negativamente - il catodo. Di conseguenza, verranno scaricati sia i cationi Na + che gli anioni Cl -, cioè diventeranno atomi neutri. La scarica avviene attraverso l'acquisizione di elettroni nel caso degli ioni Na + e la perdita di elettroni nel caso degli ioni Cl −. Cioè, il processo procede al catodo:
Na + + 1e − = Na 0 ,
E sull'anodo:
Cl − − 1e − = Cl
Poiché ogni atomo di cloro ha un elettrone spaiato, la loro singola esistenza è sfavorevole e gli atomi di cloro si combinano in una molecola di due atomi di cloro:
Сl∙ + ∙Cl \u003d Cl 2
Pertanto, in totale, il processo che si verifica all'anodo è scritto più correttamente come segue:
2Cl - - 2e - = CI 2
Cioè, abbiamo:
Catodo: Na + + 1e − = Na 0
Anodo: 2Cl - - 2e - = Cl 2
Riassumiamo la bilancia elettronica:
Na + + 1e − = Na 0 |∙2
2Cl − − 2e − = Cl 2 |∙1<
Aggiungi i lati sinistro e destro di entrambe le equazioni mezze reazioni, noi abbiamo:
2Na + + 2e − + 2Cl − − 2e − = 2Na 0 + Cl 2
Riduciamo due elettroni nello stesso modo in cui si fa in algebra, otteniamo l'equazione ionica dell'elettrolisi:
2NaCl (l.) => 2Na + Cl 2
Da un punto di vista teorico, il caso sopra considerato è il più semplice, poiché nel fuso cloruro di sodio, tra gli ioni caricati positivamente, c'erano solo ioni sodio, e tra quelli negativi solo anioni cloro.
In altre parole, né i cationi Na + né gli anioni Cl − avevano "concorrenti" per il catodo e l'anodo.
E cosa accadrà, ad esempio, se invece di una fusione di cloruro di sodio, viene fatta passare una corrente attraverso la sua soluzione acquosa? In questo caso si osserva anche la dissociazione del cloruro di sodio, ma la formazione di sodio metallico in una soluzione acquosa diventa impossibile. Dopotutto, sappiamo che il sodio, un rappresentante dei metalli alcalini, è un metallo estremamente attivo che reagisce molto violentemente con l'acqua. Se il sodio non può essere ridotto in tali condizioni, cosa verrà ridotto al catodo?
Ricordiamo la struttura della molecola d'acqua. È un dipolo, cioè ha un polo negativo e uno positivo:
È grazie a questa proprietà che è in grado di "attaccare" sia la superficie del catodo che la superficie dell'anodo:
Possono verificarsi i seguenti processi:
2H 2 O + 2e - \u003d 2OH - + H 2
2H 2 O - 4e - \u003d O 2 + 4H +
Pertanto, si scopre che se consideriamo una soluzione di qualsiasi elettrolita, vedremo che i cationi e gli anioni formati durante la dissociazione dell'elettrolita competono con le molecole d'acqua per la riduzione al catodo e l'ossidazione all'anodo.
Quindi quali processi avranno luogo al catodo e all'anodo? Scarica di ioni formati durante la dissociazione dell'elettrolita o ossidazione/riduzione delle molecole d'acqua? O, forse, tutti questi processi avverranno simultaneamente?
A seconda del tipo di elettrolita, durante l'elettrolisi della sua soluzione acquosa sono possibili diverse situazioni. Ad esempio, i cationi di metalli alcalini, alcalino terrosi, alluminio e magnesio semplicemente non possono essere ridotti nell'ambiente acquatico, poiché la loro riduzione avrebbe dovuto comportare rispettivamente metalli alcalini, alcalino terrosi, alluminio o magnesio, ad es. metalli che reagiscono con l'acqua.
In questo caso è possibile solo la riduzione delle molecole d'acqua al catodo.
È possibile ricordare quale processo avverrà sul catodo durante l'elettrolisi di una soluzione di un qualsiasi elettrolita, seguendo i seguenti principi:
1) Se l'elettrolita è costituito da un catione metallico, che allo stato libero in condizioni normali reagisce con l'acqua, sul catodo avviene il seguente processo:
2H 2 O + 2e - \u003d 2OH - + H 2
Questo vale per i metalli che si trovano all'inizio della serie di attività Al, inclusi.
2) Se l'elettrolita è costituito da un catione metallico, che nella sua forma libera non reagisce con l'acqua, ma reagisce con gli acidi non ossidanti, avvengono due processi contemporaneamente, sia la riduzione dei cationi metallici che delle molecole d'acqua:
Io n+ + ne = Io 0
Questi metalli includono quelli compresi tra Al e H nelle serie di attività.
3) Se l'elettrolita è costituito da cationi idrogeno (acido) o cationi metallici che non reagiscono con acidi non ossidanti, vengono ripristinati solo i cationi elettrolitici:
2H + + 2e - \u003d H 2 - nel caso dell'acido
Me n + + ne = Me 0 - nel caso del sale
All'anodo, nel frattempo, la situazione è la seguente:
1) Se l'elettrolita contiene anioni di residui acidi privi di ossigeno (tranne F -), il processo della loro ossidazione avviene all'anodo, le molecole d'acqua non vengono ossidate. Ad esempio:
2Cl - - 2e \u003d Cl 2
S 2- − 2e = S o
Gli ioni fluoruro non vengono ossidati all'anodo perché il fluoro non è in grado di formarsi in una soluzione acquosa (reagisce con l'acqua)
2) Se l'elettrolita contiene ioni idrossido (alcali), vengono ossidati al posto delle molecole d'acqua:
4OH - - 4e - \u003d 2H 2 O + O 2
3) Se l'elettrolita contiene un residuo acido contenente ossigeno (ad eccezione dei residui di acido organico) o uno ione fluoruro (F -) sull'anodo, il processo di ossidazione delle molecole d'acqua avviene:
2H 2 O - 4e - \u003d O 2 + 4H +
4) Nel caso di un residuo acido di un acido carbossilico sull'anodo, avviene il seguente processo:
2RCOO - - 2e - \u003d R-R + 2CO 2
Esercitati a scrivere equazioni di elettrolisi per varie situazioni:
Esempio 1
Scrivi le equazioni per i processi che si verificano al catodo e all'anodo durante l'elettrolisi di una fusione di cloruro di zinco, nonché l'equazione generale dell'elettrolisi.
Soluzione
Quando il cloruro di zinco si scioglie, si dissocia:
ZnCl 2 \u003d Zn 2+ + 2Cl -
Inoltre, si dovrebbe prestare attenzione al fatto che è il fuso di cloruro di zinco che subisce l'elettrolisi e non la soluzione acquosa. In altre parole, senza opzioni, al catodo può verificarsi solo la riduzione dei cationi di zinco e l'ossidazione degli ioni cloruro all'anodo. senza molecole d'acqua
Catodo: Zn 2+ + 2e − = Zn 0 |∙1
Anodo: 2Cl − − 2e − = Cl 2 |∙1
ZnCl 2 \u003d Zn + Cl 2
Esempio #2
Scrivi le equazioni per i processi che si verificano al catodo e all'anodo durante l'elettrolisi di una soluzione acquosa di cloruro di zinco, nonché l'equazione generale dell'elettrolisi.
Poiché in questo caso una soluzione acquosa è sottoposta all'elettrolisi, allora, in teoria, le molecole d'acqua possono partecipare all'elettrolisi. Poiché lo zinco si trova nella serie di attività tra Al e H, ciò significa che sia la riduzione dei cationi di zinco che delle molecole d'acqua avverrà al catodo.
2H 2 O + 2e - \u003d 2OH - + H 2
Zn 2+ + 2e - = Zn 0
Lo ione cloruro è il residuo acido dell'acido privo di ossigeno HCl, quindi, nella competizione per l'ossidazione all'anodo, gli ioni cloruro "vincono" sulle molecole d'acqua:
2Cl - - 2e - = CI 2
In questo caso particolare, è impossibile scrivere l'equazione dell'elettrolisi complessiva, poiché il rapporto tra idrogeno e zinco rilasciato al catodo è sconosciuto.
Esempio #3
Scrivi le equazioni per i processi che si verificano al catodo e all'anodo durante l'elettrolisi di una soluzione acquosa di nitrato di rame, nonché l'equazione generale dell'elettrolisi.
Il nitrato di rame in soluzione è in uno stato dissociato:
Cu(NO 3) 2 \u003d Cu 2+ + 2NO 3 -
Il rame è nella serie di attività a destra dell'idrogeno, cioè i cationi di rame saranno ridotti al catodo:
Cu 2+ + 2e − = Cu 0
Lo ione nitrato NO 3 - è un residuo acido contenente ossigeno, il che significa che nell'ossidazione all'anodo, gli ioni nitrato "perdono" in competizione con le molecole d'acqua:
2H 2 O - 4e - \u003d O 2 + 4H +
In questo modo:
Catodo: Cu 2+ + 2e − = Cu 0 |∙2
2Cu 2+ + 2H 2 O = 2Cu 0 + O 2 + 4H +
L'equazione ottenuta come risultato dell'addizione è l'equazione ionica dell'elettrolisi. Per ottenere l'equazione dell'elettrolisi molecolare completa, è necessario aggiungere 4 ioni nitrato ai lati sinistro e destro dell'equazione ionica risultante come controioni. Quindi otterremo:
2Cu(NO 3) 2 + 2H 2 O = 2Cu 0 + O 2 + 4HNO 3
Esempio #4
Scrivi le equazioni per i processi che si verificano al catodo e all'anodo durante l'elettrolisi di una soluzione acquosa di acetato di potassio, nonché l'equazione generale dell'elettrolisi.
Soluzione:
L'acetato di potassio in una soluzione acquosa si dissocia in cationi potassio e ioni acetato:
CH 3 COOK \u003d CH 3 COO − + K +
Il potassio è un metallo alcalino, cioè è nella serie elettrochimica delle tensioni proprio all'inizio. Ciò significa che i suoi cationi non possono essere scaricati al catodo. Invece, le molecole d'acqua verranno ripristinate:
2H 2 O + 2e - \u003d 2OH - + H 2
Come accennato in precedenza, i residui acidi degli acidi carbossilici "vincono" nella competizione per l'ossidazione delle molecole d'acqua all'anodo:
2CH 3 COO - - 2e - \u003d CH 3 -CH 3 + 2CO 2
Quindi, sommando il bilancio elettronico e sommando le due equazioni delle semireazioni al catodo e all'anodo, otteniamo:
Catodo: 2H 2 O + 2e − = 2OH − + H 2 |∙1
Anodo: 2CH 3 COO - - 2e - \u003d CH 3 -CH 3 + 2CO 2 | ∙ 1
2H 2 O + 2CH 3 COO - \u003d 2OH - + H 2 + CH 3 -CH 3 + 2CO 2
Abbiamo ottenuto l'equazione completa dell'elettrolisi in forma ionica. Aggiungendo due ioni potassio ai lati sinistro e destro dell'equazione e sommandoli con i controioni, otteniamo l'equazione dell'elettrolisi completa in forma molecolare:
2H 2 O + 2CH 3 CUOCO \u003d 2KOH + H 2 + CH 3 -CH 3 + 2CO 2
Esempio #5
Scrivi le equazioni per i processi che si verificano al catodo e all'anodo durante l'elettrolisi di una soluzione acquosa di acido solforico, nonché l'equazione generale dell'elettrolisi.
L'acido solforico si dissocia in cationi idrogeno e ioni solfato:
H 2 SO 4 \u003d 2H + + SO 4 2-
I cationi idrogeno H + saranno ridotti al catodo e le molecole d'acqua saranno ossidate all'anodo, poiché gli ioni solfato sono residui acidi contenenti ossigeno:
Catodo: 2Н + + 2e − = H 2 |∙2
Anodo: 2H 2 O - 4e - = O 2 + 4H + |∙1
4H + + 2H 2 O \u003d 2H 2 + O 2 + 4H +
Riducendo gli ioni idrogeno nei lati sinistro, destro e sinistro dell'equazione, otteniamo l'equazione per l'elettrolisi di una soluzione acquosa di acido solforico:
2H 2 O \u003d 2H 2 + O 2
Come si può vedere, l'elettrolisi di una soluzione acquosa di acido solforico si riduce all'elettrolisi dell'acqua.
Esempio #6
Scrivi le equazioni per i processi che si verificano al catodo e all'anodo durante l'elettrolisi di una soluzione acquosa di idrossido di sodio, nonché l'equazione generale dell'elettrolisi.
Dissociazione dell'idrossido di sodio:
NaOH = Na + + OH -
Solo le molecole d'acqua saranno ridotte al catodo, poiché il sodio è un metallo altamente attivo e solo gli ioni idrossido all'anodo:
Catodo: 2H 2 O + 2e − = 2OH − + H 2 |∙2
Anodo: 4OH − − 4e − = O 2 + 2H 2 O |∙1
4H 2 O + 4OH - \u003d 4OH - + 2H 2 + O 2 + 2H 2 O
Riduciamo due molecole d'acqua a sinistra ea destra e 4 ioni idrossido, e giungiamo alla conclusione che, come nel caso dell'acido solforico, l'elettrolisi di una soluzione acquosa di idrossido di sodio si riduce all'elettrolisi dell'acqua.
L'elettrolisi (in greco elektron - ambra + lisi - decomposizione) è una reazione chimica che si verifica quando una corrente continua passa attraverso un elettrolita. Questa è la decomposizione di sostanze nelle loro parti componenti sotto l'influenza di una corrente elettrica.
Il processo di elettrolisi è il movimento di cationi (ioni caricati positivamente) al catodo (caricati negativamente) e ioni caricati negativamente (anioni) all'anodo (caricati positivamente).
Quindi, anioni e cationi corrono rispettivamente all'anodo e al catodo. È qui che avviene la reazione chimica. Per risolvere con successo compiti su questo argomento e scrivere reazioni, è necessario separare i processi al catodo e all'anodo. Ecco come verrà costruito questo articolo.
catodo
I cationi sono attratti dal catodo - ioni carichi positivamente: Na +, K +, Cu 2+, Fe 3+, Ag +, ecc.
Per stabilire quale reazione avviene al catodo, prima di tutto, è necessario determinare l'attività del metallo: la sua posizione nella serie elettrochimica delle tensioni metalliche.

Se sul catodo appare un metallo attivo (Li, Na, K), al suo posto vengono ripristinate le molecole d'acqua, da cui viene rilasciato idrogeno. Se il metallo è di media attività (Cr, Fe, Cd), sia l'idrogeno che il metallo stesso vengono rilasciati al catodo. I metalli inattivi vengono isolati al catodo in forma pura (Cu, Ag).
Noto che l'alluminio è considerato il confine tra metalli attivi e di media attività in una serie di tensioni. Durante l'elettrolisi sul catodo, i metalli fino all'alluminio (incluso!) non vengono ripristinati, al loro posto vengono ripristinate le molecole d'acqua - viene rilasciato idrogeno.
Nel caso in cui gli ioni idrogeno - H + vengano forniti al catodo (ad esempio, durante l'elettrolisi degli acidi HCl, H 2 SO 4), l'idrogeno viene ridotto dalle molecole acide: 2H + - 2e = H 2
Anodo
Gli anioni sono attratti dall'anodo - ioni caricati negativamente: SO 4 2-, PO 4 3-, Cl -, Br -, I -, F -, S 2-, CH 3 COO -.

Durante l'elettrolisi degli anioni contenenti ossigeno: SO 4 2-, PO 4 3- - non vengono ossidati anioni sull'anodo, ma molecole d'acqua, da cui viene rilasciato ossigeno.
Gli anioni privi di ossigeno vengono ossidati e rilasciano i corrispondenti alogeni. Ione solfuro nell'ossidazione dell'ossidazione dello zolfo. Un'eccezione è il fluoro: se colpisce l'anodo, viene scaricata una molecola d'acqua e viene rilasciato ossigeno. Il fluoro è l'elemento più elettronegativo e quindi è un'eccezione.
Gli anioni degli acidi organici vengono ossidati in modo speciale: il radicale adiacente al gruppo carbossilico viene raddoppiato e il gruppo carbossilico stesso (COO) viene convertito in anidride carbonica - CO 2 .
Esempi di soluzioni
Durante il processo di formazione, potresti imbatterti in metalli che vengono omessi nelle serie di attività. Nella fase di allenamento, puoi utilizzare una vasta gamma di attività sui metalli.

Ora saprai esattamente cosa viene rilasciato sul catodo ;-)
Quindi, facciamo pratica. Scopriamo cosa si forma sul catodo e sull'anodo durante l'elettrolisi di soluzioni di AgCl, Cu(NO 3) 2 , AlBr 3 , NaF, FeI 2 , CH 3 COOLi.

A volte nei compiti è necessario registrare la reazione dell'elettrolisi. Ti informo: se capisci cosa si forma al catodo e cosa c'è all'anodo, allora scrivere la reazione non è difficile. Prendi, ad esempio, l'elettrolisi di NaCl e scrivi la reazione:
NaCl + H 2 O → H 2 + Cl 2 + NaOH
Il sodio è un metallo attivo, quindi l'idrogeno viene rilasciato al catodo. L'anione non contiene ossigeno, alogeno - viene rilasciato cloro. Scriviamo l'equazione in modo da non poter far evaporare il sodio senza lasciare traccia :) Il sodio reagisce con l'acqua per formare NaOH.
Scriviamo la reazione di elettrolisi per CuSO 4:
CuSO 4 + H 2 O → Cu + O 2 + H 2 SO 4
Il rame appartiene ai metalli a bassa attività, quindi, nella sua forma pura, viene rilasciato al catodo. L'anione contiene ossigeno, quindi l'ossigeno viene rilasciato nella reazione. Lo ione solfato non scompare da nessuna parte, si combina con l'idrogeno dell'acqua e si trasforma in acido solforico.
Sciogliere l'elettrolisi
Tutto ciò di cui abbiamo discusso fino a questo punto riguarda l'elettrolisi di soluzioni in cui il solvente è l'acqua.
La chimica industriale deve affrontare un compito importante: ottenere metalli (sostanze) in una forma pura. I metalli inattivi (Ag, Cu) possono essere facilmente ottenuti mediante elettrolisi delle soluzioni.
Ma che dire dei metalli attivi: Na, K, Li? Dopotutto, durante l'elettrolisi delle loro soluzioni, non vengono rilasciate al catodo nella loro forma pura, al loro posto vengono ridotte le molecole d'acqua e viene rilasciato idrogeno. È qui che tornano utili i fondi che non contengono acqua.

Nei fusi anidri le reazioni sono scritte ancora più semplicemente: le sostanze si scompongono nelle loro parti costituenti:
AlCl 3 → Al + Cl 2
LiBr → Li + Br2
© Bellevich Yury Sergeevich 2018-2020
Questo articolo è stato scritto da Yury Sergeevich Bellevich ed è di sua proprietà intellettuale. La copia, la distribuzione (compresa la copia su altri siti e risorse su Internet) o qualsiasi altro uso di informazioni e oggetti senza il previo consenso del titolare del diritto d'autore è punibile dalla legge. Per ottenere i materiali dell'articolo e il permesso di utilizzarli, si prega di contattare
Indietro avanti
Attenzione! L'anteprima della diapositiva è solo a scopo informativo e potrebbe non rappresentare l'intera portata della presentazione. Se sei interessato a questo lavoro, scarica la versione completa.
I risultati dell'USE mostrano che i compiti sul tema "Elettrolisi" rimangono difficili per i laureati. Nel curriculum scolastico, un numero insufficiente di ore è assegnato allo studio di questo argomento. Pertanto, quando si preparano gli studenti per l'esame, è necessario studiare questo problema in modo molto dettagliato. La conoscenza delle basi dell'elettrochimica aiuterà il laureato a superare con successo l'esame e continuare la propria formazione in un istituto di istruzione superiore Per studiare l'argomento "Elettrolisi" a un livello sufficiente, è necessario svolgere lavori preparatori con i laureati che superano l'esame : - considerare le definizioni dei concetti di base nell'argomento "Elettrolisi"; - analizzare il processo di elettrolisi fusi e soluzioni di elettroliti; - fissare le regole per la riduzione dei cationi al catodo e l'ossidazione degli anioni all'anodo (il ruolo delle molecole d'acqua durante l'elettrolisi delle soluzioni); - la formazione di abilità per redigere equazioni per il processo di elettrolisi (processi catodici e anodici); - insegnare agli studenti a svolgere compiti standard di livello base (compiti), alto e alto livello di complessità. Elettrolisi- processo redox che si verifica in soluzioni e fusioni di elettroliti con il passaggio di una corrente elettrica continua. In una soluzione o fusione di un elettrolita, si dissocia in ioni. Quando la corrente elettrica viene attivata, gli ioni acquisiscono un movimento diretto e possono verificarsi processi redox sulla superficie degli elettrodi. Anodo- un elettrodo positivo, su di esso sono in corso processi di ossidazione.
Il catodo è un elettrodo negativo, su di esso stanno avvenendo processi di recupero.
Sciogliere l'elettrolisi utilizzato per ottenere metalli attivi situati in una serie di tensioni fino all'alluminio (compreso).
L'elettrolisi del cloruro di sodio si scioglie
K(-) Na + + 1e -> Na 0
A(+) 2Cl - - 2e -> Cl 2 0
2NaCl (corrente elettronica) -> 2Na + Cl 2 (solo per elettrolisi fusa).
L'alluminio si ottiene per elettrolisi di una soluzione di ossido di alluminio in criolite fusa (Na 3 AlF 6).
2Al 2 O 3 (corrente elettronica) -> 4Al + 3O 2
K(-)Al 3+ +3e‾ ->Al
A(+)2O 2‾ -2e‾ ->O 2
Elettrolisi di una fusione di idrossido di potassio.
KOH->K + +OH‾
K(-) K + + 1e -> K 0
A (+) 4OH - - 4e -> O 2 0 + 2H 2 O
4KOH (corrente elettrica) -> 4K 0 + O 2 0 + 2H 2 O
L'elettrolisi di soluzioni acquose è più difficile, poiché in questo caso le molecole d'acqua possono essere ridotte o ossidate sugli elettrodi.
Elettrolisi di soluzioni acquose di saliè più complicato a causa della possibile partecipazione di molecole d'acqua al catodo e all'anodo nei processi dell'elettrodo.
Regole dell'elettrolisi in soluzioni acquose.
Sul catodo:
1. Cationi situati in una serie di tensioni metalliche dal litio all'alluminio (incluso), nonché cationi NH4+ non vengono ripristinate, le molecole d'acqua vengono invece ripristinate:
2H 2 O + 2e->H 2 + 2OH -
2. I cationi situati nella serie di tensioni dopo l'alluminio all'idrogeno possono essere ridotti insieme alle molecole d'acqua:
2H 2 O + 2e->H2+2OH -
Zn2+ + 2e->Zn 0
3. I cationi situati in una serie di tensioni dopo il ripristino completo dell'idrogeno: Ag + + 1e->Ag 0
4. Gli ioni idrogeno sono ridotti in soluzioni acide: 2H + + 2e->H 2
Sull'anodo:
1. Anioni contenenti ossigeno e F-- non si ossidano, al loro posto si ossidano le molecole d'acqua:
2H 2 O - 4e->O2+4H+
2.Anioni di zolfo, iodio, bromo, cloro (in questa sequenza) vengono ossidati a sostanze semplici:
2Cl - - 2e->cl 2 0 S 2- - 2e->S0
3. Gli ioni idrossido sono ossidati in soluzioni alcaline:
4OH - - 4e->O 2 + 2 H 2 O
4. Gli anioni sono ossidati in soluzioni di sali di acidi carbossilici:
2 R - COSÌ - - 2e->R - R + 2CO 2
5. Quando si utilizzano anodi solubili, l'anodo stesso invia elettroni al circuito esterno a causa dell'ossidazione degli atomi del metallo da cui è composto l'anodo:
Cu 0 - 2e->Tu 2+
Esempi di processi di elettrolisi in soluzioni acquose di elettroliti
Esempio 1 K 2 SO 4 -> 2K + + SO 4 2-
K(-)2H 2 O + 2e‾ -> H 2 + 2OH -
A(+)2H 2 O – 4e‾ -> O 2 + 4H +
L'equazione generale dell'elettrolisi: 2H 2 O (corrente elettrica) -> 2 H 2 + O 2
Esempio 2. NaCl ->Na + +Cl‾
K(-)2H 2 O + 2e‾ -> H 2 + 2OH -
A(+) 2Cl - - 2e -> Cl 2 0
2NaCl + 2H 2 O (corrente el.) -> H 2 + 2NaOH + Cl 2
Esempio 3. Cu SO 4 -> Cu 2+ + SO 4 2-
K(-) Cu 2+ + 2e‾ -> Cu
A(+)2H 2 O – 4e‾ -> O 2 + 4H +
Equazione generale dell'elettrolisi: 2 Cu SO 4 + 2H 2 O (corrente elettrica) -> 2Cu + O 2 + 2H 2 SO 4
Esempio 4. CH 3 COONa->CH 3 COO‾ +Na +
K(-)2H 2 O + 2e‾ -> H 2 + 2OH -
A(+)2CH 3 COO‾– 2e‾ ->C 2 H 6 +2CO 2
Equazione generale dell'elettrolisi:
CH 3 COONa + 2H 2 O (corrente el.) -> H 2 + 2NaHCO 3 + C 2 H 6
Compiti del livello base di complessità
Test sull'argomento “Elettrolisi di fusi e soluzioni di sali. Una serie di sollecitazioni dei metalli”.
1. L'alcali è uno dei prodotti dell'elettrolisi in una soluzione acquosa:
1) KCI 2) CuSO 4 3) FeCI 2 4) AgNO 3
2. Durante l'elettrolisi di una soluzione acquosa di nitrato di potassio, all'anodo viene rilasciato quanto segue: 1) Circa 2 2) NO 2 3) N 2 4) H 23. Durante l'elettrolisi di una soluzione acquosa si forma idrogeno: 1) CaCI 2 2) CuSO 4 3) Hg (NO 3) 2 4) AgNO 34. La reazione è possibile tra: 1) Ag e K 2 SO 4 (soluzione) 2) Zn e KCI (soluzione) 3) Mg e SnCI 2(soluzione) 4) Ag e CuSO 4 (soluzione) 5. Durante l'elettrolisi di una soluzione di ioduro di sodio al catodo, il colore della tornasole in soluzione: 1) rosso 2 ) blu 3) viola 4) giallo6. Durante l'elettrolisi di una soluzione acquosa di fluoruro di potassio, al catodo viene rilasciato: 1) idrogeno 2) acido fluoridrico 3) fluoro 4) ossigeno
Compiti sull'argomento "Elettrolisi"
1. L'elettrolisi di 400 g di una soluzione salina comune al 20% è stata interrotta quando al catodo sono stati rilasciati 11,2 litri (n.a.) di gas. Il grado di decomposizione del sale originale (in%) è:
1) 73 2) 54,8 3) 36,8 4) 18
La soluzione del problema. Componiamo l'equazione della reazione di elettrolisi: 2NaCl + 2H 2 O → H 2 + Cl 2 + 2NaOHm (NaCl) \u003d 400 ∙ 0,2 \u003d 80 g di sale erano in soluzione ν (H 2) \u003d 11,2 / 22,4 \u003d 0,5 mol ν(NaCl)=0,5∙2=1 mol(NaCl)= 1∙58,5=58,5 g di sale è stato decomposto durante l'elettrolisi Grado di decomposizione del sale 58,5/80=0,73 o 73%.Risposta: il 73% del sale si è decomposto.
2. Elettrolisi condotta di 200 g di una soluzione al 10% di solfato di cromo (III) fino a completo consumo del sale (il metallo viene rilasciato sul catodo). La massa (in grammi) di acqua utilizzata è:
1) 0,92 2) 1,38 3) 2,76 4) 5,52
La soluzione del problema. Componiamo l'equazione della reazione di elettrolisi: 2Cr 2 (SO 4) 3 + 6H 2 O → 4Cr + 3O 2 + 6H 2 SO 4m (Cr 2 (SO 4) 3) \u003d 200 ∙ 0,1 \u003d 20g ν (Cr 2 ( SO 4) 3) \u003d 20 / 392 \u003d 0,051 mol ν (H 2 O) \u003d 0,051 ∙ 3 \u003d 0,153 mol (H 2 O) \u003d 0,153 18 \u003d 2,76 gCompiti di maggiore complessità B3
1. Stabilire una corrispondenza tra la formula del sale e l'equazione del processo che si verifica all'anodo durante l'elettrolisi della sua soluzione acquosa.
3. Stabilire una corrispondenza tra la formula del sale e l'equazione del processo che si verifica sul catodo durante l'elettrolisi della sua soluzione acquosa.
5. Stabilire una corrispondenza tra il nome della sostanza ei prodotti di elettrolisi della sua soluzione acquosa.
Risposte: 1 - 3411, 2 - 3653, 3 - 2353, 4 - 2246, 5 - 145. Pertanto, studiando l'argomento dell'elettrolisi, i laureati padroneggiano bene questa sezione e mostrano buoni risultati nell'esame. Lo studio del materiale è accompagnato da una presentazione su questo argomento.