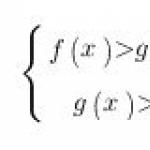Nel 2018, il VPR in chimica nel grado 11 è stato effettuato su decisione dell'organizzazione educativa, per i laureati che non hanno scelto questa materia per il superamento dell'esame.
Le versioni 2018 torneranno utili per preparare il CDF 2019.
VPR in chimica grado 11 2018 opzioni + risposte
Il lavoro di verifica in chimica è condizionalmente suddiviso in quattro blocchi di contenuto: “Fondamenti teorici della chimica”, “Chimica inorganica”, “Chimica organica”, “Metodi di apprendimento della chimica. Fondamenti sperimentali di chimica. Chimica e vita.
I laureati che partecipano alla stesura del VLOOKUP in chimica devono dimostrare un livello di conoscenza di base della materia:
- scrivere un'equazione per una reazione chimica
- simulare un esperimento chimico in base alla sua descrizione,
- spiegare la condizionalità delle proprietà e dei metodi per ottenere le sostanze in base alla loro composizione e struttura.
Il lavoro di prova per il grado 11 include 15 compiti di vari livelli di complessità.
Sono disponibili 1,5 ore (90 minuti) per completare l'intera opera.
I compiti inclusi nel lavoro di prova controllano la padronanza
laureati con determinate abilità e metodi di azione che
soddisfare i requisiti per il livello di formazione dei laureati.
Tabella per convertire i punteggi del VLOOKUP di chimica nella valutazione
Istruzione generale secondaria
Linea UMK VV Lunin. Chimica (10-11) (base)
Linea UMK VV Lunin. Chimica (10-11) (U)
Linea UMK N. E. Kuznetsova. Chimica (10-11) (base)
Linea UMK N. E. Kuznetsova. Chimica (10-11) (profonda)
VPR in chimica. Grado 11
Il lavoro di prova comprende 15 attività. Per completare il lavoro di chimica, viene assegnata 1 ora e 30 minuti (90 minuti).
Scrivi le tue risposte ai compiti nel campo previsto per loro. Se scrivi una risposta errata, cancellala e scrivine una nuova accanto ad essa.
Durante l'esecuzione del lavoro, è consentito utilizzare:
- Sistema periodico di elementi chimici D.I. Mendeleev;
- tabella di solubilità di sali, acidi e basi in acqua;
- serie elettrochimica di tensioni di metalli;
- calcolatrice non programmabile.
Quando completi i compiti, puoi utilizzare una bozza. Le bozze delle voci non saranno esaminate o valutate.
Ti consigliamo di completare i compiti nell'ordine in cui sono stati assegnati. Per risparmiare tempo, salta l'attività che non puoi completare subito e passa a quella successiva. Se dopo aver completato tutto il lavoro ti rimane del tempo, puoi tornare alle attività perse.
I punti che ottieni per le attività completate sono riassunti. Cerca di completare il maggior numero di compiti possibile e di segnare il maggior numero di punti.
Ti auguriamo successo!
Dal corso di chimica, conosci i seguenti metodi per separare le miscele: decantazione, filtrazione, distillazione (distillazione), azione magnetica, evaporazione, cristallizzazione.
Sulla fig. 1-3 mostrano esempi dell'uso di alcuni di questi metodi.
Determinare quale dei metodi per separare le miscele mostrati in figura può essere utilizzato per separare:
- cereali e limatura di ferro che vi entravano;
- acqua e sali disciolti in essa.
Registrare nella tabella il numero della figura e il nome del metodo corrispondente per separare la miscela.
Soluzione
1.1. La separazione di una miscela di cereali e limatura di ferro si basa sulla proprietà del ferro di essere attratto da un magnete. Figura 3

1.2. La separazione di una miscela di acqua e sali disciolti avviene durante la distillazione. L'acqua, una volta riscaldata al punto di ebollizione, evapora e, raffreddandosi in un refrigeratore d'acqua, scorre in un recipiente pre-preparato. Immagine 1.

La figura mostra un diagramma della distribuzione degli elettroni sui livelli di energia di un atomo di un determinato elemento chimico.

Sulla base dello schema proposto, completare le seguenti attività:
- annotare il simbolo dell'elemento chimico a cui corrisponde il dato modello dell'atomo;
- annotare il numero del periodo e il numero del gruppo nel Sistema periodico degli elementi chimici D.I. Mendeleev, in cui si trova questo elemento;
- determinare se la sostanza semplice che forma questo elemento appartiene a metalli o non metalli.
Registra le tue risposte in una tabella.
Soluzione
La figura mostra un diagramma della struttura di un atomo:

Dove viene mostrato un kernel con uno specifico Carica positiva(n), ed elettroni che ruotano attorno al nucleo su strati di elettroni. Sulla base di ciò, viene chiesto loro di nominare questo elemento, annotare il numero del periodo e il gruppo in cui si trova. Scopriamolo:
- Gli elettroni ruotano su tre strati di elettroni, il che significa che l'elemento si trova nel terzo periodo.
- Sull'ultimo strato di elettroni ruotano 5 elettroni, il che significa che l'elemento si trova nel 5° gruppo.
Compito 3
Sistema periodico di elementi chimici D.I. Mendeleev è un ricco archivio di informazioni sugli elementi chimici, le loro proprietà e le proprietà dei loro composti. Quindi, ad esempio, è noto che con un aumento del numero atomico di un elemento chimico, il carattere di base dell'ossido diminuisce in periodi e aumenta in gruppi.
Dati questi modelli, disporre i seguenti elementi nell'ordine di rafforzare la basicità degli ossidi: Na, Al, Mg, B. Scrivi i simboli degli elementi nella sequenza desiderata.
Risposta: ________
Soluzione
Come sapete, la somma dei protoni nel nucleo di un atomo è uguale al numero ordinale dell'elemento. Ma il numero di protoni non ci è dato. Poiché un atomo è una particella elettricamente neutra, il numero di protoni (particelle con carica positiva) nel nucleo di un atomo è uguale al numero di elettroni (particelle con carica negativa) che ruotano attorno al nucleo dell'atomo. Il numero totale di elettroni che ruotano attorno al nucleo è 15 (2 + 8 + 5), quindi il numero di serie dell'elemento è 15. Ora resta da esaminare il sistema periodico degli elementi chimici di DI Mendeleev e trovare il numero 15 Questo è P (fosforo). Poiché il fosforo ha 5 elettroni nell'ultimo strato di elettroni, non è metallico; i metalli sull'ultimo strato hanno da 1 a 3 elettroni.
Dati 4 elementi dal sistema periodico di Mendeleev: Na, Al, Mg, B. È necessario disporli in modo che aumenti la basicità degli ossidi da essi formati. Rispondendo a questa domanda del VPR, è necessario ricordare come cambiano le proprietà metalliche nei periodi e nei gruppi del sistema periodico.
Nei periodi da sinistra a destra, le proprietà metalliche diminuiscono e le proprietà non metalliche aumentano. Di conseguenza, diminuisce anche la basicità degli ossidi.
Nei gruppi, sottogruppi principali, le proprietà metalliche aumentano dall'alto verso il basso. Di conseguenza, anche la basicità dei loro ossidi aumenta nello stesso ordine.
Ora diamo un'occhiata agli elementi che ci vengono dati. Due di loro sono nel terzo gruppo; sono B e Al. L'alluminio nel gruppo è inferiore al boro, quindi le sue proprietà metalliche sono più pronunciate di quelle del boro. Di conseguenza, la basicità dell'ossido di alluminio è più pronunciata.
Al, Na e Mg si trovano nel 3° periodo. Poiché le proprietà metalliche diminuiscono nel periodo da sinistra a destra, diminuiscono anche le proprietà di base dei loro ossidi. Detto questo, puoi disporre questi elementi nel seguente ordine:
Compito 4
La tabella seguente mostra alcune delle caratteristiche dei tipi covalenti e ionici di legame chimico.
Utilizzando queste informazioni, determinare il tipo di legame chimico: 1) in cloruro di calcio (CaCl 2); 2) in una molecola di idrogeno (H 2).
- In cloruro di calcio _____________
- In una molecola di idrogeno _____________
Soluzione
Nella domanda successiva, è necessario determinare quale tipo di legame chimico è tipico per CaCl 2 e quale per H 2. Questa tabella ha un suggerimento:
Usandolo, si può determinare che CaCl 2 è caratterizzato da un legame di tipo ionico, poiché è costituito da un atomo di metallo (Ca) e atomi non metallici (Cl), e per H 2 è covalente non polare, poiché questa molecola è costituita da atomi dello stesso elemento è l'idrogeno.
Le sostanze inorganiche complesse possono essere distribuite condizionatamente, cioè classificate in quattro classi, come mostrato nel diagramma. In questo schema, inserisci i nomi mancanti delle due classi e due formule di sostanze che sono rappresentative delle classi corrispondenti.

Soluzione
Il prossimo compito è testare la conoscenza delle principali classi di sostanze inorganiche.
La tabella deve riempire le celle vuote. Nei primi due casi si riportano le formule delle sostanze, è necessario attribuirle ad una certa classe di sostanze; negli ultimi due, invece, scrivi formule per i rappresentanti di queste classi.
La CO 2 è una sostanza complessa, costituita da atomi di vari elementi. Uno dei quali è l'ossigeno. È al secondo posto. È un ossido. La formula generale per gli ossidi è RO, dove R è un elemento specifico.
RbOH - appartiene alla classe delle basi. Comune a tutte le basi è la presenza di un gruppo OH, che è connesso ad un metallo (l'eccezione è NH 4 OH, dove il gruppo OH è connesso al gruppo NH 4).
Gli acidi sono sostanze complesse costituite da atomi di idrogeno e un residuo acido.
Pertanto, le formule di tutti gli acidi iniziano con atomi di idrogeno, seguiti da un residuo acido. Ad esempio: HCl, H 2 SO 4, HNO 3, ecc.
Infine, scrivi la formula per il sale. I sali sono sostanze complesse costituite da atomi di metallo e un residuo acido, ad esempio NaCl, K 2 SO 4.

Per completare le attività 6-8, utilizzare le informazioni contenute in questo testo
L'ossido di fosforo (V) (P 2 O 5) si forma durante la combustione del fosforo nell'aria ed è una polvere bianca. Questa sostanza è molto attiva e reagisce con l'acqua rilasciando una grande quantità di calore, quindi viene utilizzata come essiccante per gas e liquidi, un agente di rimozione dell'acqua nelle sintesi organiche.
Il prodotto di reazione dell'ossido di fosforo(V) con l'acqua è acido fosforico (H 3 PO 4). Questo acido mostra tutte le proprietà generali degli acidi, ad esempio interagisce con le basi. Tali reazioni sono chiamate reazioni di neutralizzazione.
I sali dell'acido fosforico, come il fosfato di sodio (Na 3 PO 4), trovano l'applicazione più ampia. Sono introdotti nella composizione di detersivi e detersivi, utilizzati per ridurre la durezza dell'acqua. Allo stesso tempo, l'ingresso di quantità eccessive di fosfati con le acque reflue nei corpi idrici contribuisce al rapido sviluppo di alghe (fioritura dell'acqua), il che rende necessario controllare attentamente il contenuto di fosfati nelle acque reflue e naturali. Per rilevare lo ione fosfato, è possibile utilizzare la reazione con il nitrato d'argento (AgNO 3), che è accompagnato dalla formazione di un precipitato giallo di fosfato d'argento (Ag 3 PO 4)
Compito 6
1) Scrivi un'equazione per la reazione del fosforo con l'ossigeno.
Risposta: ________
2) Su quale proprietà dell'ossido di fosforo(V) si basa il suo uso come agente essiccante?
Risposta: ________
Soluzione
In questo compito, è necessario formulare un'equazione per la reazione del fosforo con l'ossigeno e rispondere alla domanda sul perché il prodotto di questa reazione viene utilizzato come agente essiccante.
Scriviamo l'equazione di reazione e disponiamo i coefficienti: 4 P + 5 o 2 = 2 P 2 o 5
L'ossido di fosforo è usato come agente essiccante per la sua capacità di rimuovere l'acqua dalle sostanze.
Compito 7
1) Scrivere un'equazione molecolare per la reazione tra acido fosforico e idrossido di sodio.
Risposta: ________
2) Indicare a quale tipo di reazioni (composti, decomposizioni, sostituzioni, scambi) appartiene l'interazione dell'acido fosforico con l'idrossido di sodio.
Risposta: ________
Soluzione
Nel settimo compito, è necessario elaborare un'equazione per la reazione tra acido fosforico e idrossido di sodio. Per fare ciò, è necessario ricordare che questa reazione si riferisce a reazioni di scambio, quando sostanze complesse scambiano le loro parti costitutive.
h 3 PO 4 + 3 NaOH = N / A 3 PO 4 + 3 h 2 o
Qui vediamo che l'idrogeno e il sodio nei prodotti di reazione sono invertiti.
Compito 8
1) Scrivere un'equazione ionica abbreviata per la reazione tra soluzioni di fosfato di sodio (Na 3 PO 4) e nitrato d'argento.
Risposta: ________
2) Specificare il segno di questa reazione.
Risposta: ________
Soluzione
Scriviamo l'equazione di reazione in forma ionica ridotta tra soluzioni di fosfato di sodio e nitrato d'argento.
Secondo me, devi prima scrivere l'equazione di reazione in forma molecolare, quindi disporre i coefficienti e determinare quale delle sostanze lascia il mezzo di reazione, cioè precipita, viene rilasciata sotto forma di gas o forma un basso sostanza dissociante (ad esempio acqua). La tabella della solubilità ci aiuterà in questo.
N / A 3 PO 4 + 3 AgNO 3 = Ag 3 PO 4 + 3 NaNO 3
La freccia verso il basso accanto al fosfato d'argento indica che questo composto è insolubile in acqua e precipita, quindi non subisce dissociazione ed è scritto sotto forma di molecola nelle equazioni di reazione ionica. Scriviamo l'equazione ionica completa per questa reazione:
Ora cancelliamo gli ioni che si sono spostati dal lato sinistro dell'equazione al lato destro senza cambiare la loro carica:
3Na + + PO 4 3– + 3Ag + + 3NO 3 – = Ag 3 PO 4 + 3Na + + 3NO 3 –
Tutto ciò che non è barrato, lo scriviamo in un'equazione ionica abbreviata:
PO 4 3– + 3Ag + = Ag3PO4
Compito 9
Viene fornito lo schema della reazione redox.
Mn (OH) 2 + KBrO 3 → MnO 2 + KBr + H 2 O
1. Fai un bilancio elettronico di questa reazione.
Risposta: ________
2. Specificare l'agente ossidante e l'agente riducente.
Risposta: ________
3. Disporre i coefficienti nell'equazione di reazione.
Risposta: ________
Soluzione
Il prossimo compito è spiegare il processo redox.
Mn(OH) 2 + KBrO 3 → MnO 2 + KBr + H 2 O
Per fare ciò, scriviamo accanto al simbolo di ogni elemento il suo stato di ossidazione in questo composto. Non dimenticare che in totale tutti gli stati di ossidazione di una sostanza sono pari a zero, poiché sono elettricamente neutri. Anche lo stato di ossidazione di atomi e molecole costituiti dalla stessa sostanza è zero.
Mn 2+ (O 2– H +) 2 + K + Br 5+ O 3 2– → Mn 4+ O 2 2– + K + Br – + H 2 + O 2 –
Mn2+ (O 2– H +) 2 + K+Br 5+ O 3 2– → Mn4+ O 2 2– + K + Br – + H 2 + O 2 –
Mn 2+ –2e → Mn 4+ Il processo di donazione di elettroni è l'ossidazione. Allo stesso tempo, lo stato di ossidazione dell'elemento aumenta durante la reazione. Questo elemento è un agente riducente, ripristina il bromo.
Br 5+ +6e → Br - Il processo di accettazione degli elettroni - recupero. In questo caso, lo stato di ossidazione dell'elemento diminuisce durante la reazione. Questo elemento è un agente ossidante, ossida il manganese.
Un agente ossidante è una sostanza che accetta elettroni e si riduce allo stesso tempo (lo stato di ossidazione di un elemento diminuisce).
Un agente riducente è una sostanza che dona elettroni e si ossida allo stesso tempo (lo stato di ossidazione di un elemento diminuisce). A scuola si scrive così.
Il numero 6, che sta dopo la prima barra verticale, è il minimo comune multiplo dei numeri 2 e 6 - il numero di elettroni donati dall'agente riducente e accettati dall'agente ossidante. Dividiamo questa cifra per il numero di elettroni donati dall'agente riducente e otteniamo il numero 3, è posto dopo la seconda linea verticale ed è il coefficiente nell'equazione di reazione redox, che è posto davanti all'agente riducente, che cioè manganese. Quindi, dividi il numero 6 per il numero 6, il numero di elettroni ricevuti dall'ossidante. Otteniamo il numero 1. Questo è il coefficiente che viene posto nell'equazione di reazione redox davanti all'agente ossidante, cioè il bromo. Inseriamo i coefficienti nell'equazione ridotta, quindi li trasferiamo nell'equazione principale.
3Mn(OH) 2 + KBrO 3 → 3MnO 2 + KBr + 3H 2 O
Se necessario, sistemiamo altri coefficienti in modo che il numero di atomi dello stesso elemento sia lo stesso. Alla fine, controlliamo il numero di atomi di ossigeno prima e dopo la reazione. Se il loro numero è uguale, allora abbiamo fatto tutto bene. In questo caso, è necessario mettere un fattore 3 davanti all'acqua.
Lo schema di trasformazione è dato:
Cu → CuCl 2 → Cu(OH) 2 → Cu(NO 3) 2
Scrivi le equazioni molecolari delle reazioni mediante le quali queste trasformazioni possono essere eseguite.
Soluzione
Risolviamo lo schema di trasformazione:
Cu→ CuCl 2 → Cu(Oh) 2 → Cu(NO 3 ) 2
1) Cu + cl 2 = CuCl 2 - Attiro la tua attenzione sul fatto che il rame non interagisce con l'acido cloridrico, poiché è nella serie di tensioni dei metalli dopo l'idrogeno. Pertanto, una delle reazioni principali. Interazione diretta con il cloro.
2) CuCl 2 + 2 NaOH = Cu(Oh) 2 + 2 NaCl- reazione di scambio.
3) Cu(Oh) 2 + 2 HNO 3 = Cu(NO 3 ) 2 + 2 h 2 o-l'idrossido di rame è un precipitato, pertanto i sali dell'acido nitrico non sono adatti per ricavarne nitrato di rame.
Stabilire una corrispondenza tra il nome di una sostanza organica e la classe/gruppo di appartenenza di tale sostanza: per ogni posizione indicata da una lettera, selezionare la posizione corrispondente indicata da un numero.
Scrivi nella tabella i numeri selezionati sotto le lettere corrispondenti.
1. Il metanolo è un alcol. I nomi degli alcoli monoidrici terminano in -ol, quindi A2.
2. L'acetilene è un idrocarburo insaturo. Questo nome banale è dato qui. Secondo la nomenclatura sistematica, si chiama etino. Scegliere B4.
3. Il glucosio è un carboidrato, un monosaccaride. Pertanto, scegliamo IN 1.
Negli schemi di reazioni chimiche proposti, inserire le formule delle sostanze mancanti e inserire i coefficienti ove necessario.
|
1) C 6 H 6 + Br 2 |
C 6 H 5 -Br + ... |
2) CH 3 CH + ... → CH 3 CH 3 OH
Soluzione
Occorre inserire le formule delle sostanze mancanti e, se necessario, disporre i coefficienti:
1) C 6 H 6 + Br 2 ⎯AlBr 3 → C 6 H 5 –Br + HBr Le reazioni di sostituzione sono caratteristiche del benzene e dei suoi omologhi, pertanto, in questa reazione, il bromo sostituisce l'atomo di idrogeno nel benzene e si ottiene il bromobenzene.
2) CH 3 CHO + H 2 → CH 3 CH 2 OH Reazione di riduzione dell'acetaldeide ad alcol etilico.
L'acido acetico è ampiamente utilizzato nell'industria chimica e alimentare. Le soluzioni acquose di acido acetico (additivo alimentare E260) sono utilizzate nella cucina domestica, nell'inscatolamento e nella produzione di sostanze medicinali e aromatiche. Questi ultimi includono numerosi esteri dell'acido acetico, come l'acetato di propile.
Calcolare quanti grammi di acetato di propile (CH 3 COOC 3 H 7) possono essere ottenuti facendo reagire 300 g di acido acetico (CH 3 COOH) con propanolo-1 (C 3 H 7 OH) al 100% di resa pratica. Annotare l'equazione di reazione e la soluzione dettagliata del problema.
Risposta: ________
Compito. Scriviamo una breve condizione del problema:
m (CH 3 COOS 3 H 7) \u003d?
1. La condizione del problema dice che l'acido acetico ha reagito con una massa di 300 g Determiniamo il numero di moli in 300 g di esso. Per fare ciò, utilizziamo il triangolo magico, dove n è il numero di moli.

Sostituiamo i numeri: n \u003d 300 g: 60 g / mol \u003d 5 mol. Pertanto, l'acido acetico ha reagito con l'alcol propilico in una quantità di 5 mol. Successivamente, determiniamo quante moli di CH 3 COOS 3 H 7 sono formate da 5 moli di CH 3 COOH. Secondo l'equazione di reazione, l'acido acetico reagisce in una quantità di 1 mole e si forma anche 1 mole di estere, poiché non ci sono coefficienti nell'equazione di reazione. Pertanto, se prendiamo un acido nella quantità di 5 mol, anche l'etere sarà 5 mol. Perché reagiscono in un rapporto 1:1.
Bene, resta da calcolare la massa di 5 moli di etere usando questo triangolo.
Sostituendo i numeri, otteniamo: 5 mol 102 g / mol \u003d 510 g.
Risposta: massa di etere = 510 g.
L'acetilene viene utilizzato come combustibile per la saldatura a gas e il taglio dei metalli, nonché come materia prima per la produzione di cloruro di vinile e altre sostanze organiche. Secondo lo schema seguente, scrivere le equazioni per le reazioni caratteristiche dell'acetilene. Quando si scrivono equazioni di reazione, utilizzare le formule strutturali delle sostanze organiche.

Soluzione
Eseguire le trasformazioni caratteristiche dell'acetilene secondo lo schema sopra.
Vorrei dire che l'acetilene è un idrocarburo insaturo avente 2 legami π tra atomi di carbonio, pertanto è caratterizzato da reazioni di addizione, ossidazione, polimerizzazione nel punto di rottura dei legami π. Le reazioni possono procedere in due fasi.

La soluzione di Ringer è ampiamente utilizzata in medicina come regolatore dell'equilibrio sale-acqua, un sostituto del plasma e di altri componenti del sangue. Per prepararlo, 8,6 g di cloruro di sodio, 0,33 g di cloruro di calcio e 0,3 g di cloruro di potassio vengono sciolti in 1 litro di acqua distillata. Calcolare la frazione di massa di cloruro di sodio e cloruro di calcio nella soluzione risultante. Scrivi una soluzione dettagliata al problema.
Risposta: ________
Soluzione
Per risolvere questo problema, scriviamo la sua breve condizione:
|
m(H 2 O) \u003d 1000 g. m(CaCl 2) \u003d 0,33 g. m(KCl) = 0,3 g. m(NaCl) = 8,6 g. |
Poiché la densità dell'acqua è l'unità, 1 litro di acqua avrà una massa pari a 1000 grammi. Quindi, per trovare la frazione di massa in percentuale della soluzione, usiamo il triangolo magico,
m (in-va) - la massa della sostanza; m(r-ra) - massa della soluzione; ω è la frazione di massa di una sostanza in percentuale in una data soluzione. Deriviamo una formula per trovare ω% in soluzione. Sembrerà così:
|
|
ω% (p-ra NaCl) |
Per procedere immediatamente alla ricerca della frazione di massa in percentuale della soluzione di NaCl, dobbiamo conoscere altri due valori, ovvero la massa della sostanza e la massa della soluzione. La massa della sostanza ci è nota dalle condizioni del problema e dovrebbe essere trovata la massa della soluzione. La massa della soluzione è uguale alla massa dell'acqua più la massa di tutti i sali disciolti nell'acqua. La formula per il calcolo è semplice: m (in-va) \u003d m (H 2 O) + m (NaCl) + m (CaCl 2) + m (KCl), sommando tutti i valori, otteniamo: 1000 g. + 8,6 g + 0,3 g + 0,33 g = 1009,23 g Questa sarà la massa dell'intera soluzione.
Ora troviamo la frazione di massa di NaCl nella soluzione:
Allo stesso modo, calcoliamo la massa del cloruro di calcio:
Inserendo i numeri, otteniamo:
Risposta:ω% in soluzione di NaCl = 0,85%; ω% in soluzione di CaCl 2 = 0,033%.
VPR Lavoro di verifica tutto russo - Grado di chimica 11
Spiegazioni al campione del lavoro di verifica tutto russo
Quando si familiarizza con il lavoro di prova di esempio, va tenuto presente che le attività incluse nel campione non riflettono tutte le abilità e i problemi di contenuto che verranno testati come parte del lavoro di prova tutto russo. Un elenco completo di elementi di contenuto e abilità che possono essere testati nel lavoro è fornito nel codificatore di elementi di contenuto e requisiti per il livello di formazione dei laureati per lo sviluppo del lavoro di prova tutto russo in chimica. Lo scopo del campione di lavoro di prova è quello di dare un'idea della struttura del lavoro di prova tutto russo, del numero e della forma dei compiti e del loro livello di complessità.
Istruzioni di lavoro
Il lavoro di prova comprende 15 attività. Per completare il lavoro di chimica, viene assegnata 1 ora e 30 minuti (90 minuti).
Preparare le risposte nel testo del lavoro secondo le istruzioni per i compiti. Se scrivi una risposta errata, cancellala e scrivine una nuova accanto ad essa.
Durante l'esecuzione del lavoro, è consentito utilizzare i seguenti materiali aggiuntivi:
– Sistema periodico di elementi chimici D.I. Mendeleev;
- tabella di solubilità di sali, acidi e basi in acqua;
– serie elettrochimiche di tensioni di metalli;
- calcolatrice non programmabile.
Quando completi i compiti, puoi utilizzare una bozza. Le bozze delle voci non saranno esaminate o valutate.
Ti consigliamo di completare i compiti nell'ordine in cui sono stati assegnati. Per risparmiare tempo, salta l'attività che non puoi completare subito e passa a quella successiva. Se dopo aver completato tutto il lavoro ti rimane del tempo, puoi tornare alle attività perse.
I punti che ottieni per le attività completate sono riassunti. Cerca di completare il maggior numero di compiti possibile e di segnare il maggior numero di punti.
Ti auguriamo successo!
1. Dal corso di chimica, conosci i seguenti metodi per separare le miscele: sedimentazione, filtrazione, distillazione (distillazione), azione magnetica, evaporazione, cristallizzazione. Le figure 1-3 mostrano esempi di alcuni di questi metodi.
Quale dei seguenti metodi di separazione delle miscele può essere utilizzato per la purificazione:
1) farina di limatura di ferro che vi è entrata;
2) acqua da sali inorganici disciolti in essa?
Registrare nella tabella il numero della figura e il nome del metodo corrispondente per separare la miscela.
la limatura di ferro è attratta da un magnete
durante la distillazione, dopo la condensazione del vapore acqueo, nel recipiente rimangono cristalli di sale
2. La figura mostra un modello della struttura elettronica di un atomo di una sostanza chimicaelemento.

Sulla base dell'analisi del modello proposto, svolgere le seguenti attività:
1) determinare l'elemento chimico il cui atomo ha una tale struttura elettronica;
2) indicare il numero del periodo e il numero del gruppo nel Sistema periodico degli elementi chimici D.I. Mendeleev, in cui si trova questo elemento;
3) determinare se una sostanza semplice che forma questo elemento chimico appartiene a metalli o non metalli.
Registra le tue risposte in una tabella.
Risposta:
N; 2; 5 (o V); metalloide
per determinare l'elemento chimico, devi calcolare il numero totale di elettroni, che vediamo in figura (7)
prendendo la tavola periodica, possiamo facilmente determinare l'elemento (il numero di elettroni trovati è uguale al numero atomico dell'elemento) (N-azoto)
successivamente determiniamo il numero del gruppo (colonna verticale) (5) e la natura di questo elemento (non metallico)
3. Sistema periodico di elementi chimici D.I. Mendeleev- un ricco archivio di informazioni sugli elementi chimici, le loro proprietà e proprietà dei loro composti, sui modelli di modifica di queste proprietà, sui metodi per ottenere le sostanze, nonché sulla loro presenza in natura. Quindi, ad esempio, è noto che con un aumento del numero ordinale di un elemento chimico nei periodi, i raggi degli atomi diminuiscono e nei gruppi aumentano.
Dati questi modelli, disporre i seguenti elementi in ordine di raggi atomici crescenti: N, C, Al, Si. Annotare le designazioni degli elementi nella sequenza corretta.
Risposta: ____________________________
N → C → Si → Al
4. La tabella seguente elenca le proprietà caratteristiche delle sostanze che hanno una struttura molecolare e ionica.
Utilizzando queste informazioni, determinare quale struttura hanno le sostanze azoto N2 e sale da cucina NaCl. Scrivi la tua risposta nell'apposito spazio:
1) azoto N2 ________________________________________________________________
2) sale da cucina NaCl _________________________________________________
azoto N2 - struttura molecolare;
sale da cucina NaCl - struttura ionica
5. Le sostanze inorganiche complesse possono essere distribuite condizionatamente, cioè classificate in quattro gruppi, come mostrato nel diagramma. In questo schema, per ciascuno dei quattro gruppi, inserire i nomi dei gruppi mancanti o le formule chimiche delle sostanze (un esempio delle formule) appartenenti a questo gruppo.

Si registrano i nomi dei gruppi: basi, sali;
si annotano le formule delle sostanze dei gruppi corrispondenti
CaO, basi, HCl, sali
Leggi il testo seguente ed esegui le attività 6-8.
Nell'industria alimentare viene utilizzato l'additivo alimentare E526, che è idrossido di calcio Ca (OH) 2. Trova applicazione nella produzione di: succhi di frutta, pappe, cetrioli sott'aceto, sale da cucina, pasticceria e dolci.
È possibile la produzione di idrossido di calcio su scala industriale mescolando ossido di calcio con acqua, questo processo è chiamato spegnimento.
L'idrossido di calcio è stato ampiamente utilizzato nella produzione di materiali da costruzione come calce, intonaco e malte di gesso. Ciò è dovuto alla sua abilità interagiscono con l'anidride carbonica CO2 contenuto nell'aria. La stessa proprietà di una soluzione di idrossido di calcio viene utilizzata per misurare la quantità di anidride carbonica nell'aria.
Una proprietà utile dell'idrossido di calcio è la sua capacità di agire come flocculante che purifica le acque reflue dalle particelle sospese e colloidali (compresi i sali di ferro). Viene anche utilizzato per aumentare il pH dell'acqua, poiché l'acqua naturale contiene sostanze (ad esempio, acidi), provocando corrosione nei tubi idraulici.
1. Scrivere un'equazione molecolare per la reazione per produrre idrossido di calcio, che
menzionato nel testo.
2. Spiega perché questo processo è chiamato estinzione.
Risposta:__________________________________________________________________________
________________________________________________________________________________
1) CaO + H 2 O \u003d Ca (OH) 2
2) Quando l'ossido di calcio interagisce con l'acqua, una grande quantità di
la quantità di calore, quindi l'acqua bolle e sibila, come se colpisse carbone ardente, quando il fuoco viene estinto con acqua (o "l'estinzione di questo processo si chiama perché di conseguenza si forma la calce spenta")
1. Scrivere un'equazione molecolare per la reazione tra idrossido di calcio e anidride carbonica
gas, di cui si parla nel testo.
Risposta:__________________________________________________________________________
2. Spiegare quali caratteristiche di questa reazione consentono di utilizzarla per rilevare
anidride carbonica nell'aria.
Risposta:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
2) Come risultato di questa reazione, si forma una sostanza insolubile: carbonato di calcio, si osserva l'opacizzazione della soluzione iniziale, che consente di giudicare la presenza di anidride carbonica nell'aria (qualitativa
reazione alla CO 2)
1. Crea un'equazione ionica abbreviata della reazione menzionata nel testo tra
idrossido di calcio e acido cloridrico.
Risposta:__________________________________________________________________________
2. Spiegare perché questa reazione viene utilizzata per aumentare il pH dell'acqua.
Risposta:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH - + H + = H 2 O (Ca(OH) 2+ 2HCl = CaCl2 + 2H2O)
2) La presenza di acido nell'acqua naturale provoca bassi valori di pH di quest'acqua. L'idrossido di calcio neutralizza l'acido e i valori di pH aumentano
La scala del pH esiste da 0-14. da 0-6 - ambiente acido, 7 - ambiente neutro, 8-14 - ambiente alcalino
9. Viene fornito lo schema della reazione redox.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O
1. Fai un bilancio elettronico di questa reazione.
Risposta:__________________________________________________________________________
2. Specificare l'agente ossidante e l'agente riducente.
Risposta:__________________________________________________________________________
3. Disporre i coefficienti nell'equazione di reazione.
Risposta:__________________________________________________________________________
1) Bilancio elettronico compilato:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 - 2ē → S 0 | 2 | 1 |
2) Si indica che lo zolfo nello stato di ossidazione –2 (o H 2 S) è un agente riducente e il ferro nello stato di ossidazione +3 (o Fe 2 O 3) è un agente ossidante;
3) L'equazione di reazione è composta:
3H 2 S + Fe 2 O 3 \u003d 2FeS + S + 3H 2 O
10. Lo schema delle trasformazioni è dato:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Scrivi le equazioni di reazione molecolare che possono essere utilizzate per eseguire
trasformazioni indicate.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
Le equazioni di reazione corrispondenti allo schema di trasformazione sono scritte:
1) Fe + 2HCl = FeCl 2 + H 2
2) FeCl 2 + 2AgNO 3 \u003d Fe (NO 3) 2 + 2AgCl
3) Fe(NO 3) 2 + 2KOH = Fe(OH) 2 + 2KNO 3
(Sono consentiti altri che non contraddicono la condizione di impostazione dell'equazione
reazioni.)
11. Stabilire una corrispondenza tra la formula della sostanza organica e la classe/gruppo a cui appartiene questa sostanza: per ogni posizione indicata da una lettera, selezionare la posizione corrispondente indicata da un numero.
Scrivi nella tabella i numeri selezionati sotto le lettere corrispondenti.
Risposta:
| UN | B | V |
- C3H8 - CnH2n + 2 - alcano
- C3H6 - CnH2n- alchene
- C2H6O - CnH2n + 2O- alcol
12. Negli schemi di reazioni chimiche proposti, inserire le formule delle sostanze mancanti e disporre i coefficienti.
1) C 2 H 6 + ……………..… → C 2 H 5 Cl + HCl
2) C 3 H 6 + ……………..… → CO 2 + H 2 O
1) C 2 H 6 + Cl 2 → C 2 H 5 Cl + HCl
2) 2C 3 H 6 + 9O 2 → 6CO 2 + 6H 2 O
(Sono possibili quote frazionarie.)
13. Il propano brucia con basse emissioni di sostanze tossiche nell'atmosfera, quindi viene utilizzata come fonte di energia in molti settori, ad esempio negli accendini a gas e per il riscaldamento delle case di campagna.
Quale volume di anidride carbonica (N.O.) si forma durante la combustione completa di 4,4 g di propano?
Scrivi una soluzione dettagliata al problema.
Risposta:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) È stata compilata un'equazione per la reazione della combustione del propano:
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 O
2) n (C 3 H 8) \u003d 4,4 / 44 \u003d 0,1 mol
n (CO 2) \u003d 3n (C 3 H 8) \u003d 0,3 mol
3) V (O 2) \u003d 0,3 22,4 \u003d 6,72 l
14. L'alcol isopropilico è usato come solvente universale: fa parte di prodotti chimici domestici, profumi e cosmetici, liquidi lavavetri per auto. Secondo lo schema seguente, crea le equazioni per le reazioni per ottenere questo alcol. Quando si scrivono equazioni di reazione, utilizzare le formule strutturali delle sostanze organiche.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Le equazioni di reazione sono scritte corrispondenti allo schema:

(Sono consentiti altri che non contraddicono la condizione di impostare l'equazione di reazione.)
15. La soluzione fisiologica in medicina è chiamata soluzione allo 0,9% di cloruro di sodio in acqua. Calcolare la massa di cloruro di sodio e la massa di acqua necessaria per preparare 500 g di soluzione salina. Scrivi una soluzione dettagliata al problema.
Risposta:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCl) = 4,5 g
2) m(acqua) = 495,5 g
m(r-ra) = 500 g m(sale) = x
x/500 * 100%= 0,9%
m(sali) = 500* (0,9/100)= 4,5 g
© 2017 Servizio federale per la supervisione dell'istruzione e della scienza della Federazione Russa
Il 27 aprile 2017, per la prima volta, il lavoro di verifica tutto russo del VPR in chimica si è svolto in 11 classi in modalità test.
Sito ufficiale di VPR (StatGrad)- vpr.statgrad.org
Opzioni VPR in chimica 11th grade 2017
| № | Scarica le risposte (criteri di valutazione) |
| Opzione 11 | risposte |
| Opzione 12 | risposte |
| Opzione 13 | risposte |
| Opzione 14 | risposte |
| Opzione 15 | opzione 15 risposta |
| Opzione 16 | opzione 16 risposta |
| Opzione 17 | opzione 17 risposta |
| Opzione 18 | opzione 18 risposta |
Per conoscere le opzioni esemplari per il lavoro sul sito Web ufficiale della FIPI, vengono pubblicate opzioni demo con risposte e descrizioni.
Campioni VPR in chimica 11° grado 2017 (versione demo)
Il lavoro di prova comprende 15 attività. Per completare il lavoro di chimica, viene assegnata 1 ora e 30 minuti (90 minuti).
Durante l'esecuzione del lavoro, è consentito utilizzare i seguenti materiali aggiuntivi:
– Sistema periodico di elementi chimici D.I. Mendeleev;
- tabella di solubilità di sali, acidi e basi in acqua;
– serie elettrochimiche di tensioni di metalli;
- calcolatrice non programmabile.
La struttura e il contenuto del lavoro di verifica tutto russo del VPR in chimica
Ogni versione di VLOOKUP contiene 15 attività di vari tipi e livelli di complessità. Le opzioni includono assegnazioni di vari formati.
Queste attività presentano differenze nella forma richiesta di registrazione della risposta. Quindi, ad esempio, la risposta può essere: una sequenza di numeri, simboli; le parole; formule di sostanze; equazioni di reazione.
Il lavoro contiene 4 compiti di maggiore complessità (i loro numeri di serie: 9, 10, 13, 14). Questi compiti sono più difficili, poiché la loro attuazione comporta la complessa applicazione delle seguenti abilità:
– redigere equazioni di reazione che confermino le proprietà delle sostanze e/o la relazione tra varie classi di sostanze, e il bilancio elettronico della reazione redox;
Spiegare la condizionalità delle proprietà e dei metodi per ottenere le sostanze in base alla loro composizione e struttura;
– modellare un esperimento chimico in base alla sua descrizione.
Quando completi i compiti, puoi utilizzare una bozza. Le bozze delle voci non saranno esaminate o valutate.
CERCA.VERT. Chimica. Grado 11. 10 opzioni per attività tipiche. Drozdov AA

M.: 20 1 7. - 9 6 pag.
Questo manuale è pienamente conforme allo standard educativo statale federale (seconda generazione). Il libro contiene 10 varianti di compiti tipici dell'All-Russian Testing Work (VPR) in chimica per studenti dell'undicesimo anno. La raccolta è destinata a studenti, insegnanti e metodologi dell'undicesimo anno che utilizzano compiti standard per prepararsi al lavoro di prova tutto russo in chimica.
Formato: PDF
La dimensione: 3,4 MB
Guarda, scarica:drive.google
Istruzioni di lavoro, 4
Opzione 1 5
Opzione 2 12
Opzione 3 19
Opzione 4 26
Opzione 5 33
Opzione 6 40
Opzione 7 47
Opzione 8 54
Opzione 9 61
Opzione 10 68
Sistema di valutazione del lavoro di prova 75
Risposte 76
Applicazioni 93
Il lavoro di prova comprende 15 attività. Per completare il lavoro di chimica, viene assegnata 1 ora e 30 minuti (90 minuti).
Preparare le risposte nel testo del lavoro secondo le istruzioni per i compiti. Se scrivi una risposta errata, cancellala e scrivine una nuova accanto ad essa.
Durante l'esecuzione del lavoro, è consentito utilizzare i seguenti materiali aggiuntivi:
- Sistema periodico di elementi chimici D.I. Mendeleev;
- tabella di solubilità di sali, acidi e basi in acqua;
- serie elettrochimiche di tensioni di metalli;
- calcolatrice non programmabile.
Quando completi i compiti, puoi utilizzare una bozza. Le bozze delle voci non saranno esaminate o valutate.
Ti consigliamo di completare i compiti nell'ordine in cui sono stati assegnati. Per risparmiare tempo, salta l'attività che non puoi completare subito e passa a quella successiva. Se dopo aver completato tutto il lavoro ti rimane del tempo, puoi tornare alle attività perse.
I punti che ottieni per le attività completate sono riassunti. Cerca di completare il maggior numero di compiti possibile e di segnare il maggior numero di punti.