Riešenia zohrávajú kľúčovú úlohu v prírode, vede a technológiách. Voda je základom života, vždy obsahuje rozpustené látky. Sladká voda riek a jazier obsahuje málo rozpustených látok, zatiaľ čo morská voda obsahuje asi 3,5% rozpustených solí.
Primárny oceán (v čase vzniku života na Zemi) podľa predpokladov obsahoval iba 1% rozpustených solí.
"Práve v tomto prostredí sa živé organizmy najskôr vyvinuli, z tohto riešenia nabrali ióny a molekuly, ktoré sú potrebné pre ich ďalší rast a vývoj ... V priebehu času sa živé organizmy vyvíjali a transformovali, takže boli schopné opustiť vodné prostredie." a presuňte sa na pevninu a potom sa zdvihnite do vzduchu. Tieto schopnosti získali tak, že do svojich organizmov uložili vodný roztok vo forme kvapalín, ktoré obsahujú životne dôležitú zásobu iónov a molekúl “- to sú slová, ktoré slávny americký chemik, laureát nobelová cena Linus Pauling. Vo vnútri každého z nás, v každej bunke nášho tela, sú spomienky na prvotný oceán, miesto, v ktorom vznikol život - vodné riešenie, ktoré poskytuje život samotný.
V každom živom organizme cievami - tepnami, žilami a kapilárami neustále prúdi neobvyklé riešenie, ktoré tvorí základ krvi, hmotnostný podiel solí v ňom je rovnaký ako v primárnom oceáne - 0,9%. V roztokoch pôsobia aj komplexné fyzikálno -chemické procesy prebiehajúce v ľudskom a zvieracom tele. Proces asimilácie potravín je spojený s prenosom vysoko výživných látok do roztoku. Prírodné vodné roztoky priamo súvisia s procesmi tvorby pôdy, zásobovaním rastlín živiny... Taký technologické procesy v chemickom a mnohých ďalších odvetviach sa napríklad v roztokoch vyskytuje výroba hnojív, kovov, kyselín, papiera. Moderná vedaštuduje vlastnosti roztokov. Poďme zistiť, aké je riešenie?
 Roztoky sa líšia od ostatných zmesí tým, že častice zložiek sú v nich rovnomerne rozložené a zloženie bude rovnaké v akomkoľvek mikrovolume takejto zmesi.
Roztoky sa líšia od ostatných zmesí tým, že častice zložiek sú v nich rovnomerne rozložené a zloženie bude rovnaké v akomkoľvek mikrovolume takejto zmesi.
Preto boli roztoky chápané ako homogénne zmesi, ktoré pozostávajú z dvoch alebo viacerých homogénnych častí. Táto myšlienka bola založená na fyzikálnej teórii riešení.
Prívrženci fyzikálnej teórie riešení, ktorú obsadili Van't Hoff, Arrhenius a Ostwald, verili, že proces rozpúšťania je výsledkom difúzie.
DI Mendeleev a zástancovia chemickej teórie verili, že rozpustenie je výsledkom chemickej interakcie rozpustenej látky s molekulami vody. Bude teda presnejšie definovať roztok ako homogénny systém, ktorý pozostáva z častíc rozpustenej látky, rozpúšťadla a produktov ich interakcie.
V dôsledku chemickej interakcie rozpustenej látky s vodou vznikajú zlúčeniny - hydráty. Chemické interakcie sú obvykle sprevádzané tepelnými javmi. Rozpustenie kyseliny sírovej vo vode napríklad prebieha s uvoľnením takého obrovského množstva tepla, že roztok môže vrieť, a preto sa kyselina naleje do vody a nie naopak. Rozpustenie látok, ako je chlorid sodný, dusičnan amónny, je sprevádzané absorpciou tepla.
MV Lomonosov dokázal, že roztoky sa pri nižšej teplote ako rozpúšťadlo menia na ľad.
www.site, s úplným alebo čiastočným kopírovaním materiálu, je potrebný odkaz na zdroj.
Téma: Voda a roztoky.
Plán:
- Voda v prírode. Vlastnosti vody.
- Riešenia.
- Spôsoby vyjadrenia zloženia roztoku.
- Hydráty a kryštalické hydráty.
- Rozpustnosť.
- Presýtené roztoky.
- Osmóza.
- Tlak pár, roztoky.
- Zmrazenie a varenie roztokov.
- Pufrovacie roztoky.
Voda je "veľmi rozšírená látka na Zemi. Takmer tri."Štvrtý povrch zemegule je pokrytý vodou a tvorí oceány, moria, rieky a jazerá. Veľa vody je v plynnom stave ako para v atmosfére; v podobe obrovskej masy snehu a ľadu leží celoročne na vrcholoch vysokých hôr a v polárnych krajinách. V útrobách zeme je aj voda, ktorá premáča pôdu a skaly.
Prírodná voda nie je nikdy úplne čistá. Najčistejšia je dažďová voda, ale obsahuje aj malé množstvo rôznych nečistôt, ktoré zachytáva zo vzduchu.
Množstvo nečistôt v sladkých vodách sa obvykle pohybuje od 0,01 do 0,1% (hmotnosti). Morská voda obsahuje 3,5% (hmotnosti) rozpustených látok, ktorých hlavnou hmotnosťou je chlorid sodný (kuchynská soľ).
Voda, ktorá obsahuje značné množstvo vápenatých a horečnatých solí, sa nazýva tvrdá voda, na rozdiel od mäkkej vody, ako je dažďová voda. Tvrdá voda dáva mydlu málo peny a vytvára na stenách kotlov vodný kameň.
Aby sa prírodná voda zbavila častíc v nej suspendovaných, filtruje sa cez vrstvu poréznej látky, napríklad z uhlia, pálenej hliny atď. Pri filtrácii veľkého množstva vody sa používajú filtre vyrobené z piesku a štrku. Filtre tiež zachytia väčšinu baktérií. Navyše na dezinfekciu pitná voda je chlórovaný; úplná sterilizácia vody vyžaduje nie viac ako 0,7 g chlóru na 1 tonu vody.
Filtráciou sa z vody dajú odstrániť iba nerozpustné nečistoty. Rozpustené látky sa z nej odstraňujú destiláciou (destiláciou) alebo iónovou výmenou.
Voda je veľmi dôležitá v živote rastlín, zvierat a ľudí. Podľa moderných myšlienok je samotný vznik života spojený s morom. V každom organizme je voda prostredím, v ktorom prebiehajú chemické procesy, ktoré zaisťujú životnú činnosť organizmu; okrem toho sa sama zúčastňuje množstva biochemických reakcií.
Fyzikálne vlastnosti vody. Čistá voda je bezfarebná priehľadná kvapalina. Hustota vody pri prechode z tuhého do kvapalného stavu sa takmer neznižuje
pre všetky ostatné látky, ale zvyšuje sa. Keď sa voda ohreje z 0 na 4 ° C, zvýši sa aj jej hustota. Pri 4 ° C má voda maximálnu hustotu a iba pri ďalšom zahrievaní jej hustota klesá.
V živote prírody má veľký význam skutočnosť, že voda má abnormálne vysokú tepelnú kapacitu.
Vzhľadom na skutočnosť, že keď sa ľad topí, objem obsadený vodou klesá, tlak znižuje teplotu topenia ľadu. Vyplýva to z Le Chatelierovho princípu. Zvýšenie tlaku pri 0 ° C teda spôsobuje transformáciu ľadu na kvapalinu, čo znamená, že teplota topenia ľadu klesá.
Molekula vody má uhlovú štruktúru; jeho jadrá tvoria rovnoramenný trojuholník, na ktorého základe sú dva protóny, a na vrchole - jadro atómu kyslíka. Internukleárne vzdialenosti O - H sú blízke 0,1 nm, vzdialenosť medzi jadrami atómov vodíka je približne 0,15 nm. Z ôsmich elektrónov, ktoré tvoria vonkajšiu elektrónovú vrstvu atómu kyslíka v molekule vody, dva elektrónové páry tvoria kovalentné väzby O - H a zvyšné štyri elektróny sú dva nezdieľané elektrónové páry.
Atóm kyslíka v molekule vody je v stave 5p 3 -hybridizácia. Preto je uhol väzby НОН (104,3 °) blízky tetraedrickému (109,5 °). Elektróny tvoriace väzby O - H sú posunuté smerom k elektronegatívnejšiemu atómu kyslíka. V dôsledku toho atómy vodíka získavajú účinné pozitívne náboje, takže na týchto atómoch vzniknú dva kladné póly. Centrá negatívnych nábojov osamelých elektrónových párov atómu kyslíka sa nachádzajú na hybride 5p 3 -orbitaly sú posunuté vzhľadom na atómové jadro a vytvárajú dva negatívne póly.
Molekulová hmotnosť parnej vody je 18 jednotiek. Molekulová hmotnosť kvapalnej vody, stanovená štúdiom jej roztokov v iných rozpúšťadlách, sa však ukazuje byť vyššia, vyššia. Je to spôsobené tým, že v kvapalnej vode dochádza k asociácii jednotlivých molekúl vody do zložitejších agregátov (zhlukov). Tento záver potvrdzujú aj abnormálne vysoké hodnoty teplôt topenia a varu vody. Asociácia molekúl vody je spôsobená tvorbou vodíkových väzieb medzi nimi.
Voda je svojou štruktúrou hierarchiou pravidelných volumetrických štruktúr, ktoré sú založené na kryštálových útvaroch, pozostávajúcich z 57 molekúl a vzájomne reagujúcich v dôsledku voľných vodíkových väzieb. To vedie k vzniku štruktúr druhého rádu vo forme šesťuholníkov, ktoré sa skladajú z 912 molekúl vody. Vlastnosti zhlukov závisia od pomeru kyslíka a vodíka k povrchu. Konfigurácia vodných prvkov reaguje na akýkoľvek vonkajší vplyv a nečistoty, čo vysvetľuje mimoriadne labilný charakter ich interakcie. V bežnej vode je súhrn jednotlivých molekúl vody a náhodných spoločníkov 60% (deštruktúrovaná voda) a 40% sú klastre (štruktúrovaná voda).
V pevnej vode (ľad) sa atóm kyslíka každej molekuly podieľa na tvorbe dvoch vodíkových väzieb so susednými molekulami vody. Vytvorenie vodíkových väzieb vedie k takému usporiadaniu molekúl vody, v ktorom sa navzájom dotýkajú svojimi opačnými pólmi. Molekuly tvoria vrstvy, z ktorých každá je spojená s tromi molekulami patriacimi do tej istej vrstvy a s jednou zo susednej vrstvy. Štruktúra ľadu patrí k najmenej hustým štruktúram, nachádzajú sa v ňom dutiny, ktorých rozmery sú o niečo väčšie ako veľkosť molekuly.
Keď sa ľad topí, jeho štruktúra je zničená. Ale aj v kvapalnej vode sú vodíkové väzby medzi molekulami zachované: vytvárajú sa spoločníci - fragmenty štruktúr ľadu - pozostávajúce z väčšieho alebo menšieho počtu molekúl vody. Na rozdiel od ľadu však každý spoločník existuje veľmi krátko: k zničeniu niektorých a tvorbe ďalších agregátov dochádza neustále. Jednotlivé molekuly vody môžu byť umiestnené v dutinách takýchto „ľadových“ agregátov; v tomto prípade sa balenie molekúl vody stáva hustejším. Preto sa pri topení ľadu zmenšuje objem vody a zvyšuje sa jeho hustota.
Keď sa voda ohrieva, úlomkov ľadovej štruktúry v nej je stále menej, čo vedie k ďalšiemu zvýšeniu hustoty vody. V teplotnom rozmedzí od 0 do 4 ° C tento účinok prevažuje nad tepelnou rozťažnosťou, takže hustota vody sa stále zvyšuje. Pri zahriatí nad 4 ° C však prevažuje účinok zvýšeného tepelného pohybu molekúl a hustota vody klesá. Preto má voda pri 4 ° C maximálnu hustotu.
Pri zahrievaní vody sa časť tepla spotrebuje na prerušenie vodíkových väzieb (energia rozbitia vodíkovej väzby vo vode je asi 25 kJ / mol). To vysvetľuje vysokú tepelnú kapacitu vody. Vodíkové väzby medzi molekulami vody sú úplne prerušené iba vtedy, keď voda prechádza do pary.
Stavový diagram vody (alebo fázový diagram) je grafické znázornenie vzťahu medzi veličinami charakterizujúcimi stav systému a fázovými transformáciami v systéme (prechod z tuhého na kvapalný, z kvapalného do plynného atď.). Pre jednozložkové systémy sa zvyčajne používajú fázové diagramy, ktoré ukazujú závislosť fázových transformácií od teploty a tlaku; nazývajú sa stavové diagramy P-T.
Pri teplote zodpovedajúcej tomuto bodu, kritickej teplote, sú veličiny charakterizujúce fyzikálne vlastnosti kvapaliny a pary rovnaké, takže rozdiel medzi stavom kvapaliny a pary zmizne.
Existenciu kritickej teploty založil v roku 1860 D.I. Mendeleev, ktorý študoval vlastnosti kvapalín. Ukázal, že pri teplotách nad kritickou nemôže byť látka v kvapalnom stave. V roku 1869 Andrews, študujúci vlastnosti plynov, dospel k podobnému záveru.
Kritická teplota a tlak pre rôzne látky sú rôzne. Takže pre vodík = -239,9 ° C, = 1,30 MPa, pre chlór = 144 ° C, = 7,71 MPa, pre vodu = 374,2 ° C, = 22,12 MPa.
Molekuly vody sú vysoko odolné voči teplu. Pri teplotách nad 1 000 ° C sa však vodná para začína rozkladať na vodík a kyslík tvoriaci vodu. Proces rozkladu látky v dôsledku jej zahrievania sa nazýva tepelná disociácia. K tepelnej disociácii vody dochádza pri absorpcii tepla. Preto podľa princípu rovnováhy francúzskeho vedca Le Chateliera platí, že čím vyššia je teplota, tým viac sa voda rozkladá. Avšak ani pri 2 000 ° C stupeň tepelnej disociácie vody nepresahuje 2%, t.j. rovnováha medzi plynnou vodou a produktmi jej disociácie - vodíkom a kyslíkom - stále zostáva posunutá smerom k vode. Pri ochladení pod 1000 ° C je rovnováha v tomto smere takmer úplne posunutá.
Voda je vysoko reaktívna látka. Oxidy mnohých kovov a nekovov sa spájajú s vodou a vytvárajú zásady a kyseliny; niektoré soli tvoria s vodou kryštalické hydráty; najaktívnejšie kovy interagujú s vodou s vývojom vodíka.
Voda má tiež katalytické vlastnosti. Pri absencii stôp vlhkosti sa niektoré z bežných reakcií prakticky nevyskytujú; napríklad chlór nereaguje s kovmi, fluorovodík nekoroduje sklo, sodík vo vzduchu neoxiduje.
Voda sa dokáže kombinovať s množstvom látok, ktoré sú za normálnych podmienok v plynnom stave, pričom tvoria takzvané plynové hydráty. Príkladmi sú zlúčeniny xenónu, chlóru a uhľovodíkov, ktoré sa zrážajú vo forme kryštálov pri teplotách od 0 do 24 ° C (zvyčajne pri zvýšenom tlaku zodpovedajúceho plynu). Takéto zlúčeniny vznikajú v dôsledku vyplnenia medzimolekulových dutín molekulami plynu („hosť“) v štruktúre vody („hostiteľ“); nazývajú sa inklúzne zlúčeniny alebo klatráty.
V klatrátových zlúčeninách sa medzi molekulami „hosťa“ a „hostiteľa“ vytvárajú iba slabé medzimolekulové väzby; zahrnutá molekula nemôže opustiť svoje miesto v kryštálovej dutine hlavne kvôli sterickým prekážkam.Preto sú klatráty nestabilné zlúčeniny, ktoré môžu existovať iba pri relatívne nízkych teplotách.
Klatráty sa používajú na separáciu uhľovodíkov a vzácnych plynov. V poslednej dobe sa tvorba a deštrukcia plynných klatrátov (propánu a niektorých ďalších) úspešne používa na demineralizáciu vody. Vstreknutím vhodného plynu do slanej vody za zvýšeného tlaku sa získajú kryštály klatrátu podobné ľadu, pričom soli zostanú v roztoku. Snehová hmota kryštálov sa oddelí od materského lúhu a premyje. Potom sa klatráty s miernym zvýšením teploty alebo znížením tlaku rozložia a vznikne čerstvá voda a pôvodný plyn, ktorý sa opäť použije na získanie klatrátu. . Vysoká účinnosť a relatívne mierne podmienky na implementáciu tohto procesu z neho robia sľubný priemyselný spôsob odsoľovania morskej vody.
Roztok je pevný alebo kvapalný homogénny systém pozostávajúci z dvoch alebo viacerých zložiek (zložiek), ktorých relatívne množstvá sa môžu meniť v širokých medziach.
Akýkoľvek roztok pozostáva z rozpustených látok a rozpúšťadla, t.j. prostredie, v ktorom sú tieto látky rovnomerne rozložené vo forme molekúl alebo iónov. Rozpúšťadlo sa obvykle považuje za zložku, ktorá existuje v čistom stave v rovnakom stave agregácie ako výsledný roztok (napríklad v prípade vodného roztoku soli je rozpúšťadlom samozrejme voda). Ak boli obe zložky pred rozpustením v rovnakom stave agregácie (napríklad alkohol a voda), potom sa za rozpúšťadlo považuje zložka, ktorá je vo väčšom množstve.
Homogenita roztokov ich robí veľmi podobnými chemickým zlúčeninám. Uvoľnenie tepla počas rozpúšťania niektorých látok tiež naznačuje chemickú interakciu medzi rozpúšťadlom a rozpúšťanou látkou. Rozdiel medzi roztokmi a chemickými zlúčeninami je v tom, že zloženie roztoku sa môže meniť v širokých medziach.
Navyše mnohé vlastnosti jeho jednotlivých zložiek možno nájsť vo vlastnostiach roztoku, ktorý sa v prípade chemickej zlúčeniny nedodržiava. Nestálosť zloženia roztokov ich približuje k mechanickým zmesiam, ale od nich sa výrazne líšia svojou homogenitou.
Roztoky teda zaujímajú medziľahlú polohu medzi mechanickými zmesami a chemickými zlúčeninami.
Rozpustenie kryštálu v kvapaline prebieha nasledovne. Keď sa kryštál zavedie do kvapaliny, v ktorej sa môže rozpustiť, oddelia sa z jeho povrchu jednotlivé molekuly. Posledne uvedené sú v dôsledku difúzie rovnomerne rozložené v celom objeme rozpúšťadla. Oddelenie molekúl od povrchu tuhej látky je na jednej strane spôsobené ich vlastným vibračným pohybom a na druhej strane príťažlivosťou od molekúl rozpúšťadla.
Potom sa vytvorí dynamická rovnováha, v ktorej sa za jednotku času rozpustí toľko molekúl, koľko sa uvoľní z roztoku.
Riešenie v rovnováhe s rasami rozpúšťajúca sa látka sa nazýva nasýtený roztok.
Nasýtené roztoky sa používajú pomerne zriedka. Vo väčšine prípadov sa používajú nenasýtené roztoky, ktoré pri danej teplote obsahujú menej rozpustenej látky, ako obsahuje nasýtený roztok. V tomto prípade sa roztoky s nízkym obsahom rozpustených látok nazývajú zriedené, s vysokým obsahom koncentrované.
Je možné vyjadriť zloženie roztoku (a najmä obsah rozpustenej látky v ňom) rôzne cesty- pomocou bezrozmerných jednotiek (zlomkov alebo percent) a prostredníctvom rozmerových veličín - koncentrácia.
Spôsoby vyjadrenia zloženia roztokov
|
Meno a symbol |
Definícia |
Rozmer |
Poznámka |
|
|
Hmotnostný zlomok rozpustenej látky B, w (B) |
Pomer hmotnosti rozpustenej látky B (mB) k hmotnosti roztoku (mP). |
Bezrozmerné množstvo |
|
v 100 hmot.h. roztok obsahuje 20 hmot. vrátane NaOH |
|
Molárny podiel rozpustenej látky B, xB |
Pomer množstva druhej látky (nB) k celkovému množstvu všetkých látok, ktoré tvoria roztok, vrátane rozpúšťadla (е ni = nB + n1 + n2 + ... ni) |
Bezrozmerné množstvo |
xHCl = 0,02 alebo xHCl = 2% - |
|
|
Molarita látky B v roztoku, Cm (B) |
Pomer množstva rozpustenej látky B (nB) k hmotnosti rozpúšťadla (mB) v kg |
mol / kg = Mn |
|
C m (H2S04) = 0,1 mol / kg C m (H2S04) = 0,1 Mn v roztoku na 1 kg H20 je 0,1 mol H2S04. Riešenie sa nazýva decimálne |
|
Molárna koncentrácia látky B, CB |
Pomer množstva rozpustenej látky B (nB) k objemu roztoku (VР) |
mol / L = M |
|
C (KCl) = 2 mol / l 1 liter roztoku obsahuje 2 mol KCl |
|
Molárna koncentrácia ekvivalentov látky B, Ceq (B) |
Pomer počtu ekvivalentov rozpustenej látky B (neq) k objemu roztoku (VР) |
mol / l = n |
|
C ekv. (Na2C03) = 0,01 mol / l C ekv. (Na2C03) = 0,01 n 1 liter roztoku obsahuje 0,01 mol ekvivalentov Na2 CO3 - centimolárny roztok |
|
Súčin molárnej koncentrácie ekvivalentov látky B (Ceq (B)) podľa objemu roztoku (VР) sa rovná počtu ekvivalentov tejto látky (neq (B)). Preto zákon ekvivalentov: neq (A) + neeq (B) pre roztoky má tvar: C eq (A) V P (A) = C eq (B) V P (B). Táto rovnica sa veľmi často používa pri výpočtoch, najmä v analytickej chémii. |
||||
|
Titer roztoku látky B. |
Koncentrácia štandardného roztoku sa rovná hmotnosti látky B (mB) obsiahnutej v 1 ml roztoku |
|
T (NaCl) = 0,0250 g / ml 1 ml roztoku obsahuje 0,0250 g NaCl |
|
Väčšina látok v kryštalickom stave sa rozpúšťa v kvapalinách s absorpciou tepla. Keď sa však hydroxid sodný, uhličitan draselný, bezvodý síran meďnatý a mnoho ďalších látok rozpustí vo vode, dôjde k citeľnému zvýšeniu teploty. Teplo sa uvoľňuje aj vtedy, keď sa niektoré kvapaliny a všetky plyny rozpustia vo vode.
Množstvo tepla absorbovaného (alebo uvoľneného) počas rozpúšťania jedného molu látky sa nazýva teplo rozpúšťania tejto látky.
Rozpustné teplo má zápornú hodnotu, ak je teplo absorbované počas rozpúšťania, a kladnú hodnotu, keď sa teplo uvoľňuje. Teplota rozpúšťania dusičnanu amónneho je napríklad -26,4 kJ / mol, hydroxid draselný +55,6 kJ / mol atď.
Proces rozpúšťania je sprevádzaný výrazným zvýšením entropie systému, pretože v dôsledku rovnomernej distribúcie častíc jednej látky v druhej sa počet mikroštátov systému prudko zvyšuje. Preto napriek endotermickosti rozpúšťania väčšiny kryštálov je zmena Gibbsovej energie systému počas rozpúšťania negatívna a proces prebieha spontánne.
Keď sa kryštály rozpustia, dôjde k ich zničeniu, čo si vyžaduje spotrebu energie. Rozpustenie by preto muselo byť sprevádzané absorpciou tepla. Ak je pozorovaný opačný účinok, potom to ukazuje, že súčasne s rozpúšťaním dochádza medzi rozpúšťadlom a rozpustenou látkou k určitej interakcii, pri ktorej sa vo forme tepla uvoľní viac energie, ako sa spotrebuje, a deštrukciou kryštálovej mriežky.
Skutočne sa teraz zistilo, že keď sa mnoho látok rozpustí, ich molekuly (alebo ióny) s molekulami rozpúšťadla tvoria zlúčeniny nazývané solvatam a (z latinčiny) solvere - rozpustiť); tento proces sa nazýva solvatácia. V konkrétnom prípade, keď je rozpúšťadlom voda, sa tieto zlúčeniny nazývajú hydráty a samotný proces ich vzniku sa nazýva hydratácia.
Hydráty sú spravidla nestabilné zlúčeniny, ktoré sa v mnohých prípadoch rozkladajú už po odparení roztokov. Hydráty sú však niekedy také silné, že keď sa z roztoku uvoľňuje rozpustená látka, voda je súčasťou jej kryštálov. Látky, ktorých kryštály obsahujú molekuly vody, sa nazývajú kryštalické hydráty a voda v nich obsiahnutá sa nazýva p a -. s t a l l a z a z a asi a n asi th.
Zloženie kryštalických hydrátov je obvykle znázornené vzorcami, ktoré ukazujú, koľko kryštalizačnej vody obsahuje kryštalický hydrát. Napríklad kryštalický hydrát síranu meďnatého (síran meďnatý).
Sila väzby medzi látkou a kryštalizačnou vodou v kryštalických hydrátoch je odlišná. Mnoho z nich stráca kryštalizačnú vodu už pri izbovej teplote. Teda transparentné kryštály sódy (NaC0 3 - 10H 2 O) ľahko „eroduje“ - stráca kryštalizačnú vodu, je matná a postupne sa rozpadá na prášok. Na dehydratáciu ostatných kryštalických hydrátov je potrebné pomerne silné zahriatie.
Rozpustnosť je schopnosť látky rozpustiť sa v konkrétnom rozpúšťadle. Mierou rozpustnosti látky za daných podmienok je jej obsah v nasýtenom roztoku. Preto môže byť numerická rozpustnosť vyjadrená rovnakými spôsobmi ako kompozícia, napríklad percentuálny podiel hmotnosti rozpustenej látky k hmotnosti nasýteného roztoku alebo množstvo rozpustenej látky obsiahnuté v 1 litri nasýteného roztoku. Rozpustnosť je často vyjadrená aj počtom hmotnostných jednotiek bezvodej látky, ktoré za daných podmienok nasýtia 100 hmotnostných jednotiek rozpúšťadla; niekedy sa takto vyjadrená rozpustnosť nazýva koeficient rozpustnosti.
Rozpustnosť rôznych látok vo vode sa veľmi líši. Ak je v 100 g vody rozpustených viac ako 10 g látky, potom sa taká látka zvyčajne nazýva vysoko rozpustná; ak sa rozpustí menej ako 1 g látky, je zle rozpustná a nakoniec prakticky nerozpustná, ak do roztoku prejde menej ako 0,01 g látky.
Rozpustenie väčšiny tuhých látok je sprevádzané absorpciou tepla. Je to spôsobené vynaložením značného množstva energie na deštrukciu kryštálovej mriežky pevnej látky, ktorá zvyčajne nie je úplne kompenzovaná energiou uvoľnenou pri tvorbe hydrátov (solvátov). Aplikácia Le Chatelierovho princípu na rovnováhu medzi látkou v kryštalickom stave a jej nasýteným roztokom
prichádzame k záveru, že v prípadoch, keď sa látka rozpúšťa absorpciou energie, zvýšenie teploty by malo viesť k zvýšeniu jej rozpustnosti
Vo väčšine takýchto prípadov, keď teplota stúpa, sa vzájomná rozpustnosť kvapalín zvyšuje, až kým sa nedosiahne teplota, pri ktorej sa obe kvapaliny zmiešajú v akomkoľvek pomere.
Keď sa tuhé látky rozpustia vo vode, objem systému sa zvyčajne nevýznamne zmení. Preto je rozpustnosť látok v tuhom stave prakticky nezávislá na tlaku.
Tekutiny sa môžu tiež rozpúšťať v kvapalinách. Niektoré z nich sú navzájom nekonečne rozpustné, to znamená, že sa navzájom miešajú v akomkoľvek pomere, ako napríklad alkohol a voda, iné - navzájom sa rozpúšťajú iba do určitej hranice.
Teplota, pri ktorej sa obmedzená vzájomná rozpustnosť kvapalín stáva neobmedzenou, sa nazýva kritická teplota rozpúšťania
distribučný zákon, podľa ktorého je medzi ne distribuovaná látka schopná rozpustenia v dvoch nemiešateľných rozpúšťadlách tak, aby bol pomer jej koncentrácií v týchto rozpúšťadlách konštantnýteplota zostáva konštantná, bez ohľadu na celkové množstvo rozpustenej látky:
C1 / C2 = K
Tu С 1 a С 2 - koncentrácia rozpustenej látky v prvom a druhom rozpúšťadle; / (- takzvaný distribučný koeficient.
Rozpustenie plynov vo vode je exotermický proces. Rozpustnosť plynov preto klesá so zvyšujúcou sa teplotou. Ak necháte pohár s studená voda potom sú jeho vnútorné steny pokryté plynovými bublinami - to je vzduch, ktorý bol rozpustený vo vode, uvoľnený z neho v dôsledku zahrievania. Varením môžete z vody odstrániť všetok v ňom rozpustený vzduch.
Rozpustenie plynov v organických kvapalinách je však často sprevádzané absorpciou tepla; v takýchto prípadoch, keď teplota stúpa, rozpustnosť plynu sa zvyšuje.
Henryho zákon: Hmotnosť plynu, ktorý sa rozpúšťa pri konštantnej teplote v danom objeme kvapaliny, je priamo úmerná parciálnemu tlaku plynu.
Henryho zákon možno vyjadriť rovnicou
С = kp
kde C je hmotnostná koncentrácia plynu v nasýtenom roztoku; p je parciálny tlak; k - koeficient proporcionality, nazývaný Henryho konštanta (alebo Henryho koeficient).
Poznamenávame dôležitý dôsledok Henryho zákona: objem plynu rozpusteného pri konštantnej teplote v danom objeme kvapaliny nezávisí od jeho parciálneho tlaku.Ak je nad kvapalinou zmes niekoľkých plynov, potom je rozpustnosť každého z nich určená jeho parciálnym tlakom.
Toto je potrebné vziať do úvahy pri výpočte rozpustnosti plynov zmiešaných s inými plynmi. Plyny sa riadia Henryho zákonom pi nie príliš vysokých tlakov a navyše iba v prípade, že nevstupujú do chemickej interakcie s rozpúšťadlom. Pri vysokých tlakoch, keď sa správanie všetkých plynov výrazne líši od ideálnych, sa odchýlky od Henryho zákona pozorujú aj v prípade plynov, ktoré chemicky neinteragujú s rozpúšťadlom.
Rozpustnosť väčšiny látok klesá s klesajúcou teplotou, preto keď sú horúce nasýtené roztoky ochladené, zvyčajne sa uvoľňuje nadbytočná rozpustená látka. Ak sa však chladenie vykonáva opatrne a pomaly, pričom je roztok chránený pred možnosťou vniknutia častíc rozpustenej látky zvonku, nemusí dôjsť k jeho oddeleniu od roztoku. V tomto prípade sa získa roztok obsahujúci podstatne viac rozpustenej látky, ako je potrebné na nasýtenie pri danej teplote. Tento jav objavil a podrobne študoval ruský akademik T.E. Lovits (1794), ktorý označil takéto riešenia za presýtené. V pokojnom stave môžu zostať nezmenené roky. Stačí však hodiť do roztoku kryštál látky, ktorá je v ňom rozpustená, pretože okamžite okolo neho začnú rásť ďalšie kryštály a po krátkom čase kryštalizuje celý prebytok rozpustenej látky. Kryštalizácia niekedy začína jednoduchým pretrepaním roztoku, ako aj trením sklenenej tyčinky o steny nádoby, v ktorej sa roztok nachádza. Pri kryštalizácii sa uvoľňuje značné množstvo tepla, takže sa nádoba s roztokom znateľne zahreje. Veľmi ľahko vytvorte presýtené roztoky Na2S04 -10 H20 (Glauberova soľ), Na2B407 - 10H20 (borax), Na2S203-5H2 0 (tiosíran sodný).
Z toho, čo bolo povedané, vyplýva, že presýtené roztoky sú nestabilné systémy, ktoré môžu existovať iba v neprítomnosti pevných látok v systéme. Možnosť dlhodobej existencie takýchto roztokov sa vysvetľuje obtiažnosťou počiatočného vzhľadu najmenších „zárodočných“ kryštálov, takzvaných kryštalizačných centier, z ktorých sa kryštalizácia šíri do celej hmotnosti roztoku.
riešenie je homogénny systém. Častice rozpustenej látky a rozpúšťadla sú v náhodnom tepelnom pohybe a sú rovnomerne rozložené v celom objeme roztoku. Ak do valca vložíte koncentrovaný roztok nejakej látky, napríklad cukru, a opatrne na ňu nalejete vrstvu zriedenejšieho cukrového roztoku, potom sa cukor a voda najskôr nerovnomerne rozdelia v objeme riešenie.
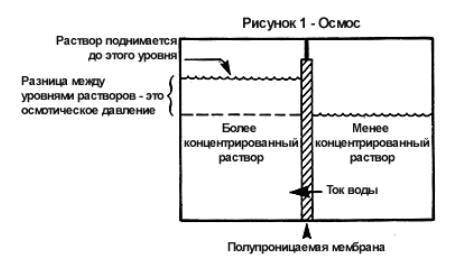 ... Molekuly cukru a vody sú však po chvíli opäť rovnomerne rozložené v celom objeme kvapaliny. Je to spôsobené tým, že molekuly cukru, náhodne sa pohybujúce, prenikajú z koncentrovaného roztoku do zriedeného a opačným smerom; ale zároveň, v akomkoľvek časovom období, prechádza viac molekúl cukru z koncentrovanejšieho roztoku do menej koncentrovaného roztoku ako zo zriedeného roztoku do koncentrovaného. Rovnakým spôsobom sa molekuly vody pohybujú v rôznych smeroch, ale viac molekúl vody prejde zo zriedeného roztoku, bohatšieho na vodu, do koncentrovaného roztoku, než za ten istý čas, sa prenesie v opačnom smere. Existuje teda riadený pohyb cukru z koncentrovaného roztoku do zriedeného a vody - zo zriedeného roztoku do koncentrovaného; v tomto prípade je každá látka premiestnená na miesto, kde je jej koncentrácia nižšia. Takýto spontánny pohyb látky, ktorý vedie k vyrovnaniu jej koncentrácie, sa nazýva difúzia.
... Molekuly cukru a vody sú však po chvíli opäť rovnomerne rozložené v celom objeme kvapaliny. Je to spôsobené tým, že molekuly cukru, náhodne sa pohybujúce, prenikajú z koncentrovaného roztoku do zriedeného a opačným smerom; ale zároveň, v akomkoľvek časovom období, prechádza viac molekúl cukru z koncentrovanejšieho roztoku do menej koncentrovaného roztoku ako zo zriedeného roztoku do koncentrovaného. Rovnakým spôsobom sa molekuly vody pohybujú v rôznych smeroch, ale viac molekúl vody prejde zo zriedeného roztoku, bohatšieho na vodu, do koncentrovaného roztoku, než za ten istý čas, sa prenesie v opačnom smere. Existuje teda riadený pohyb cukru z koncentrovaného roztoku do zriedeného a vody - zo zriedeného roztoku do koncentrovaného; v tomto prípade je každá látka premiestnená na miesto, kde je jej koncentrácia nižšia. Takýto spontánny pohyb látky, ktorý vedie k vyrovnaniu jej koncentrácie, sa nazýva difúzia.
Pri meraní osmotického tlaku rôznych roztokov sa zistilo, že veľkosť osmotického tlaku závisí od koncentrácie roztoku a od jeho teploty, ale nezávisí od povahy rozpustenej látky alebo povahy rozpúšťadla. V roku 1886 Van't Hoff ukázal, že pre roztoky nízkych koncentrácií neelektrolytov je závislosť osmotického tlaku od koncentrácie teploty roztoku vyjadrená rovnicou (Van't Hoffov zákon):
P = CRT
Tu P je osmotický tlak roztoku, kPa; C - jeho molárna koncentrácia (molarita), mol / l; R. - univerzálna plynová konštanta, 8,314 J / (mol-K); T je absolútna teplota roztoku.
Pri danej teplote je tlak nasýtených pár nad každou kvapalinou konštantnou hodnotou. Prax ukazuje, že keď je látka rozpustená v kvapaline, tlak nasýtených pár tejto kvapaliny klesá.
Tlak nasýtených pár rozpúšťadla nad roztokom je teda vždy nižší ako tlak v čistom rozpúšťadle pri tej istej teplote. Rozdiel medzi týmito hodnotami sa zvyčajne nazýva zníženie tlaku pár nad roztokom (alebo zníženie tlaku pár v roztoku). Pomer veľkosti tohto poklesu k tlaku nasýtených pár na čistom roztoku, teleso sa nazýva relatívny pokles tlaku pár nad roztokom.
Označme tlak nasýtených pár rozpúšťadla na čisté rozpúšťadlo cez p 0 , a nad riešením cez rieku. Potom bude relatívny pokles tlaku pár nad roztokom zlomkom: (Po - P) / Po
V roku 1887 francúzsky fyzik Raoul, ktorý študuje roztoky rôznych neprchavých kvapalín a látok v tuhom stave, ustanovil zákon vzťahujúci sa na zníženie tlaku pár oproti zriedeným roztokom neelektrolytov s koncentráciou:
Relatívny pokles tlaku nasýtených pár rozpúšťadla nad roztokom sa rovná molárnej frakcii rozpustenej látky.
Matematickým vyjadrením Raoultovho zákona je rovnica:
(Po - P) / Po = Ni
Tu N 2 - molárny podiel rozpustenej látky. Fenomén poklesu tlaku nasýtených pár nad roztokom vyplýva z Le Chatelierovho princípu.
Jednotlivé látky sa vyznačujú prísne definovanými teplotami prechodu z jedného stavu agregácie do druhého (teplota varu, teplota topenia, teplota sublimácie atď.). Voda pri normálnom atmosférickom tlaku (101,3 kPa) kryštalizuje pri 0 ° C a vrie pri 100 ° C.
Pri riešeniach je situácia odlišná. Prítomnosť rozpustenej látky zvyšuje teplotu varu a znižuje teplotu tuhnutia rozpúšťadla a čím je roztok silnejší, tým je koncentrovanejší. Vo väčšine prípadov z roztoku z roztoku (počas mrazenia) kryštalizuje iba rozpúšťadlo (počas mrazenia) alebo sa varí (počas varu), v dôsledku čoho sa koncentrácia roztoku počas zmrazovania alebo varu zvyšuje. To zase vedie k ešte väčšiemu zvýšeniu teploty varu a zníženiu teploty kryštalizácie. Roztok teda kryštalizuje a vrie nie pri určitej teplote, ale v určitom teplotnom rozmedzí. Teplota začiatku kryštalizácie a začiatku varu daného roztoku sa nazýva jeho teplota kryštalizácie a teplota varu.
Rozdiel medzi bodmi varu roztoku (t Komu ) a čistého rozpúšťadla (t OK ) sa nazýva zvýšenie teploty varu roztoku (Δt Komu ). Rozdiel medzi bodmi tuhnutia čistého rozpúšťadla (tОЗ) roztok (t З ) sa nazýva zníženie bodu tuhnutia roztoku (Δt H).
Δt to = t až - t v poriadku; Δt З = t ОЗ - t З.
Akákoľvek kvapalina začne vrieť pri teplote, pri ktorej tlak jej nasýtených pár dosiahne hodnotu vonkajšieho tlaku. Napríklad voda pod tlakom 101,3 kPa vrie pri 100 ° C, pretože pri tejto teplote je tlak vodnej pary presne 101,3 kPa. Ak rozpustíte vo vode nejakú neprchavú látku, tlak pár sa zníži. Na dosiahnutie tlaku pár výsledného roztoku na 101,3 kPa je potrebné roztok zahriať nad 100 ° C. Z toho vyplýva, že teplota varu roztoku je vždy vyššia ako teplota varu čistého rozpúšťadla. Zníženie bodu tuhnutia roztokov sa vysvetľuje podobným spôsobom.
Zvýšenie bodu varu a zníženie bodu tuhnutia roztokov zodpovedá Le Chatelierovmu princípu. Zvážte proces zmrazenia roztoku. Nech je medzi kvapalnou a pevnou fázou rovnováha, napríklad rovnováha voda - ľad pri 0 ° С. Dá sa to vyjadriť rovnicou:
H20 (K) H + + OH -
Ak rozpustíte určité množstvo látky vo vode, koncentrácia molekúl vody v kvapaline sa zníži a začne ju zvyšovať proces - topenie ľadu. Na dosiahnutie novej rovnováhy je potrebné znížiť teplotu.
Podľa druhého Raoultovho zákona: pri zriedených roztokoch neelektrolytov je zvýšenie teploty varu a zníženie bodu tuhnutia úmerné koncentrácii roztoku.
ΔT K = E · C m (B); ΔТ З = К · С m (В).
Tu С m (B) - molárna koncentrácia; E a K - ebulioskopické a kryoskopické konštanty, závislé iba od povahy rozpúšťadla, ale nie od povahy rozpustenej látky. Pre vodu je kryoskopická konštanta K 1,86, ebulioskopická konštanta E je 0,52. Ebulioskopické a kryoskopické metódy stanovenia sú založené na meraniach teploty varu a mrazu roztokov. molekulové hmotnosti látky.
Pufrovacie roztoky- roztoky, ktorých koncentrácia vodíkových iónov (pH) sa nemení pridaním obmedzeného množstva silnej kyseliny alebo zásady (pozri pH). B.R. pozostávajú zo zmesi roztoku slabej kyseliny a jej soli silnej zásady alebo naopak zo slabej zásady a jej soli silnej kyseliny, napríklad: CH 3 COOH + CH 3 СOONa - acetátový pufer, NH 4 OH + NHCl - tlmivý roztok amoniaku. Niekedy B.R. môže slúžiť ako zmes roztokov dvoch kyslých alebo kyslých a zásaditých solí viacbázickej slabej kyseliny a silnej zásady. Napríklad fosfát B.p. môže byť zložený z týchto dvojíc: 1) H 3P04 + NaH2P04; 2) NaH2P04 + Na2HP04; 3) Na2HP04 + Na3P04 a uhličitan - od 1) H 2 CO 3 + NaHC03; 2) NaHC03 + Na2C03 ... Akcia B. je určená prítomnosťou dvoch navzájom prepojených rovnovážnych systémov - disociácie a hydrolýzy. Na určenie hraníc účinku B. s. Zavádza sa koncept kapacity pufra, ktorý sa meria množstvom silnej kyseliny alebo zásady (v g-ekv.), ktoré sa musí pridať do 1 litra B.R., aby sa pH posunulo o jednu. Maximálna kapacita vyrovnávacej pamäte zodpovedá obsahu zložiek v ekvivalentných množstvách. V nízko mineralizovaných prírodné vody ah pufrovanie je tvorené hlavne uhličitanmi, t.j. voľná kyselina uhličitá a jej soli silných zásad (Ca, Mg, Na). V morských vodách sa na tvorbe pufračnej kapacity podieľa aj borátový nárazník. Vyrovnávacia kapacita morskej vody pri 0 O C je 11 -krát vyššia ako teplota roztoku NaCl s koncentráciou 35 OOO a 9 -krát vyššia ako destilovaná voda. O 30 O Prebytok je 25 a 19 -krát. Takéto zvýšenie pufračnej kapacity morskej vody s teplotou je spojené so zvýšením disociácie a hydrolýzy zložiek, ktoré tvoria pufrovaciu kapacitu. Destilovaná voda má o niečo väčšiu pufrovaciu kapacitu ako roztok NaCl kvôli lepšej rozpustnosti CO 2 ... Pretože hodnota pH nezávisí na koncentráciách zložiek, ale na ich pomere, potom pri riedení B.p. zostáva konštantný. Napriek vysokej tlmivej kapacite prírodných vôd procesy fotosyntézy (pozri) alebo dýchania silne ovplyvňujú hodnotu pH, pretože pomer medzi koncentráciami CO sa mení. 2 a HCO 3 - ... B.R. hrajú dôležitú úlohu v živých organizmoch. Možno dodať, že prísne fixné hodnoty pH v rôznych orgánoch vyšších zvierat a ľudí spravidla neudržiava jeden, ale celý systém biologických procesov, napríklad v krvi - roztoky pufrov na báze na uhličitany a fosfáty. Kyslé alebo zásadité odpadové vody vstupujúce do nádrže môžu byť neutralizované uhličitanovým pufrovacím systémom prírodných vôd. To tiež prispieva k zachovaniu stálosti pH vody pri pridávaní činidiel počas úpravy vody. Pri biologickom čistení odpadových vôd (pozri) sú optimálne hodnoty pH pre normálny priebeh životne dôležitých procesov mikroorganizmov podporované prítomnosťou tlmivých systémov (uhličitanový, amónny a fosfátový systém). Okrem toho B.r. široko používaný v chemickej analýze vody.
Voda a roztoky Strana 8
Vodné roztoky zahrnujú nízko koncentrované nasýtené roztoky anorganických látok, ako aj aromatické vody, ktoré neobsahujú alkohol.
Burovova tekutina. Je to vodný roztok zásaditého octanu hlinitého s koncentráciou 7,6-9,2% a hustotou 1,044-1,048. Burovova kvapalina sa predtým získavala reakciou tvorby hydrátu oxidu hlinitého s následným rozpustením v kyseline octovej. V. posledné roky vyrába sa metódou elektrolýzy vyvinutou A. I. Konovalovou. Je založený na procese anodického rozpúšťania kovového hliníka v 8% roztoku kyseliny octovej pri jeho prechode elektrický prúd... V dôsledku toho pokračuje reakcia tvorby zásaditého octanu hlinitého.
Zásaditý roztok octanu olovnatého. Olovený ocot. Je to vodný roztok zásaditého octanu olovnatého s obsahom kovového olova 16,7-17,4% a hustotou 1,225-1,230. Keď stojíte na vzduchu, roztok sa zakalí v dôsledku intenzívnej absorpcie oxidu uhličitého zo vzduchu. Liečivo sa získava interakciou octanu olovnatého a oxidu olovnatého pri zahrievaní. 3. P. Beridze navrhol získať roztok zásaditého octanu olovnatého z oxidu olovnatého a kyseliny octovej.
Samotný zásaditý roztok octanu olovnatého sa nepoužíva. Olovené mlieko sa z neho pripravuje v lekárňach podľa receptu: 2 diely zásaditého octanu olovnatého a 98 dielov vody. Olovené mlieko, podobne ako Burovova tekutina, je adstringentné a protizápalové činidlo.
Vápenná voda. Hydroxidačný roztok. Vápenná voda je nasýtený vodný roztok hydroxidu vápenatého s koncentráciou 0,15-0,17%. Prijímané reakciou hasenia páleného vápna (oxid vápenatý), po ktorom nasleduje nasýtenie roztoku hydroxidu vápenatého za studena. Hotový výrobok je číra, bezfarebná kvapalina so silne zásaditou reakciou. Používa sa perorálne zmiešaný s mliekom v detskej praxi so zvýšenou kyslosťou žalúdočnej šťavy a hnačkou.
Roztok arzenitu draselného. Fowlerov roztok arzénu. Oficiálny roztok, ktorým je vodný roztok anhydridu kyseliny arzenitej (v prípravku by to malo byť 0,97-1,03%) zmiešaný s uhličitanom draselným.
Na získanie roztoku arzenitu draselného sa 10 dielov uhličitanu draselného rozpustí v 10 dieloch vriacej vody, pridá sa 10 dielov arzenitanového anhydridu a kvapalina sa zahrieva k varu (až do úplného rozpustenia). Ďalej sa roztok zriedi 500 g vody a za miešania sa postupne pridáva zriedená kyselina chlorovodíková, kým nie je roztok neutrálny, čo je nevyhnutné na zabránenie tvorbe ďalších solí arzénu. Po neutralizácii sa do roztoku pridá 90 dielov alkoholu (objemových) a 10 dielov gáfrového alkoholu (objemových). Roztok arzenitu draselného je liekom zo zoznamu A. Do nej sa pridáva gáforový alkohol za účelom rýchlej a jednoduchej organoleptickej identifikácie.
Uchovávajte prípravok pod zámkom a kľúčom (skrinka A) v dobre uzavretých injekčných liekovkách z tmavého skla. Je predpísaný pre anémiu, neurasténiu, vyčerpanie a chronickú leukémiu.
Voňavé vody. Sú to slabo koncentrované roztoky silíc vo vode. Sú to číre alebo slabo opalizujúce kvapaliny so rozpustenou vôňou. Až na zriedkavé výnimky (kôpor a horká mandľová voda) nemajú nezávislý liečebný účel a používajú sa ako nápravné prostriedky (na korekciu zápachu).
V závislosti od spôsobu získavania sa rozlišujú jednoduché a destilované aromatické vody.
Jednoduché aromatické vody sa získavajú priamym rozpustením príslušných esenciálny olej vo vode v pomere 1: 1000 (s výnimkou ružovej vody, ktorá sa vzhľadom na silný zápach ružového oleja pripravuje v pomere 1: 4000). Pred rozpustením sa éterický olej trituruje mastencom a rozpustí v teplej (až 60 °) vode. Obe operácie sú nevyhnutné na zlepšenie procesu rozpúšťania. Prebytočný olej v roztoku sa odfiltruje cez mokrý filter.
Na zvýšenie stability jednoduchých aromatických vôd sa odporúča pridať k nim povrchovo aktívne látky, ktoré hrajú úlohu solubilizátorov: tweens, spenes, etylstearáty a ďalšie látky, ktoré zlepšujú rozpustnosť.
Destilované aromatické vody sa pripravujú destiláciou, ktorá spočíva v prechode „horúcej“ vodnej pary surovinami z esenciálnych olejov. Destilačný proces parou je založený na Daltonovom zákone, podľa ktorého sa dve nemiešateľné kvapaliny destilujú pri nižšej teplote ako každá samostatne, pretože k tvorbe pár takýchto zmesí dochádza vtedy, keď je súčet parciálnych tlakov zložiek zmesi a atmosférického tlaku rovnocenný.
Na získanie aromatických vôd sa suroviny z esenciálnych olejov umiestnia do destilačnej kocky, cez ktorú prechádza vodná para, pričom silicu strháva do kondenzátora. V chladiči chladenom studenou vodou pary vody a silice kondenzujú a odtekajú do prijímača vo forme hotovej aromatickej vody. Ak sa počas destilácie vytvorí nadbytok esenciálneho oleja, ktorý sa nerozpustí vo vode, naleje sa do oddelených nádob.
Z destilovaných aromatických vôd vo farmaceutickej praxi sa viac alebo menej používa horká mandľová voda a kôprová voda, ktoré sa vnútorne používajú na zlepšenie črevných funkcií.
Aromatické vody sa pripravujú aj s alkoholom. V tomto prípade je možné koncentráciu esenciálnych olejov v nich zvýšiť.
Vodné roztoky zahrnujú nízko koncentrované nasýtené roztoky anorganických látok, ako aj aromatické vody, ktoré neobsahujú alkohol.
Vrtná kvapalina(Liquor Burovi, Solutio Aluminii subacetatis). Je to vodný roztok zásaditého octanu hlinitého s koncentráciou 7,6-9,2% a hustotou (σ 20) 1,044-1,048. Burovova kvapalina sa predtým získavala reakciou tvorby hydrátu oxidu hlinitého s následným rozpustením v kyseline octovej. V posledných rokoch sa Burovova kvapalina vyrába metódou elektrolýzy vyvinutou v roku 1951 AI Konovalovou. Táto metóda je založená na procese anodického rozpúšťania kovového hliníka v 8% roztoku kyseliny octovej prechodom elektrického prúdu cez neho (obr. 52). V dôsledku toho prebieha reakcia tvorby zásaditého octanu hlinitého, ktorá v všeobecný pohľad možno vyjadriť nasledovne:
2A l + 2H20 + 4CH 3 COOH → 3 H 2 + 2 Al (OH) (CH 3 COO) 2
Zásaditý roztok octanu olovnatého. Olovený ocot(Solutio Plumbi subacetatis). Je to vodný roztok zásaditého octanu olovnatého s obsahom kovového olova 16,7-17,4% a hustotou 1,225-1,230. Keď stojíte na vzduchu, roztok sa zakalí v dôsledku intenzívnej absorpcie oxidu uhličitého zo vzduchu. Liečivo sa získava interakciou octanu olovnatého a oxidu olovnatého pri zahrievaní.
Samotný zásaditý roztok octanu olovnatého sa nepoužíva. V lekárňach sa z neho pripraví olovené mlieko (Aqua Plumbi) podľa receptu: 2 diely roztoku zásaditého octanu olovnatého a 98 dielov vody. Olovené mlieko, podobne ako Burovova tekutina, je adstringentné a protizápalové činidlo.
Vápenná voda. Roztok hydroxidu vápenatého(Aqua Calcis. Calcium hydroxydum solutum). Vápenná voda je nasýtený vodný roztok hydroxidu vápenatého s koncentráciou 0,15-0,17%. Prijímané reakciou hasenia páleného vápna (oxid vápenatý), po ktorom nasleduje nasýtenie roztoku hydroxidu vápenatého za studena. Za týmto účelom vezmite 1 časť oxidu vápenatého na 70 dielov čerstvo prevarenej destilovanej vody. Najprv sa prášok naleje do malého množstva (asi 1/3), aby sa získal hydroxid vápenatý, a potom sa zvyšok vody natlačí na kašovitú hmotu hydroxidu vápenatého, kým sa nezíska nasýtený vodný roztok. Hotový výrobok je číra, bezfarebná kvapalina so silne zásaditou reakciou. Používa sa perorálne zmiešaný s mliekom v detskej praxi so zvýšenou kyslosťou žalúdočnej šťavy a hnačkou.
Roztok arzenitu draselného. Fowlerov roztok arzénu(Liquor Kalii arsenitis. Liquor arsenicalis Fowleri). Oficiálny roztok (GFH, článok č. 378), čo je vodný roztok anhydridu kyseliny arzenitej (v prípravku by to malo byť 0,97-1,03%) zmiešaný s uhličitanom draselným. Reakcia tvorby liečiva je nasledovná:
Ako 2 O 3 + K 2 CO 3 1,5 H 2 O → 2KAs O 2 + CO 2 + 1,5 H 2 O.
Na získanie roztoku arzenitu draselného sa 10 dielov uhličitanu draselného rozpustí v 10 dieloch vriacej vody, pridá sa 10 dielov arzenitanového anhydridu a kvapalina sa zahrieva k varu (až do úplného rozpustenia). Ďalej sa roztok zriedi 500 g vody a za miešania sa postupne pridáva zriedená kyselina chlorovodíková, kým nie je roztok neutrálny, čo je nevyhnutné na zabránenie tvorbe ďalších solí arzénu. Po neutralizácii sa do roztoku pridá 90 dielov alkoholu (objemových) a 10 dielov gáfrového alkoholu (objemových). Roztok arzenitu draselného je prípravkom zo zoznamu A. Do tejto zmesi je pridaný gáforový koláč za účelom rýchlej a jednoduchej organoleptickej identifikácie.
Uchovávajte prípravok pod zámkom a kľúčom (skrinka A) v dobre uzavretých injekčných liekovkách z tmavého skla. Je predpísaný pre anémiu, neurasténiu, vyčerpanie a chronickú leukémiu.
Protijed na otravu kovmi(Antidotum metallorum). Ako protijed na otravu ťažkými kovmi sa používa roztok kompozície: kryštalický síran horečnatý - 3,75 dielu, uhľovodík sodný - 12,5 dielu, lúh sodný (v prepočte na 100%) - 1 diel, sírovodík - podľa potreby, voda - 1 000 dielov. Technológia prípravy roztoku je nasledovná: 500 dielov 0,2% roztoku hydroxidu sodného sa nasýti plynným sírovodíkom, ktorý sa predtým nechá prebublávať suspenziou uhličitanu vápenatého vo vode. V ďalších 500 častiach vody (čerstvo pripravenej a ochladenej na 50 ° C) sa rozpustí hydrogenuhličitan sodný a síran horečnatý. Roztok sa ochladí, zmieša s prvým roztokom, spojené roztoky sa ochladia na 2 až 3 ° C pod nulou a znova sa nasýtia sírovodíkom, kým jeho koncentrácia nedosiahne 0,4%, potom je roztok pripravený na použitie. Hotovým výrobkom je citrónovožltý roztok s mierne nazelenalým odtieňom, štipľavou vôňou sírovodíka a adstringentnou, slano-horkou chuťou.
Ióny SO 4 2- a S 2- v interakcii s ťažkými kovmi ich premieňajú na nerozpustné, neabsorbované zlúčeniny v tele, na ktorých je založený účinok lieku ako protijedu.
Voňavé vody(Aquae aromaticae). Sú to slabo koncentrované roztoky silíc vo vode. Sú to číre alebo mierne rosné kvapaliny so rozpustenou vôňou. Až na zriedkavé výnimky (kôpor a horká mandľová voda) nemajú nezávislý liečebný účel a používajú sa ako nápravné prostriedky (na korekciu zápachu).
V závislosti od spôsobu získavania sa rozlišujú jednoduché a destilované aromatické vody.
Jednoduché voňavé vody sa získavajú priamym rozpustením zodpovedajúceho esenciálneho oleja vo vode v pomere 1: 1000 (s výnimkou ružovej vody, ktorá sa vzhľadom na silný zápach ružového oleja pripravuje v pomere 1: 4000). Pred rozpustením sa éterický olej trituruje (disperguje) s mastencom a rozpustí v teplej (do 60 ° C) vode. Obe operácie sú nevyhnutné na zlepšenie procesu rozpúšťania. Prebytočný olej v roztoku sa odfiltruje cez mokrý filter.
Na zvýšenie stability jednoduchých aromatických vôd sa odporúča pridať k nim povrchovo aktívne látky, ktoré hrajú úlohu solubilizátorov: tweens, spenes, etylstearáty a ďalšie látky, ktoré zlepšujú rozpustnosť.
Destilované aromatické vody pripravené destiláciou, ktorá spočíva v prechode „horúcej“ vodnej pary surovinami esenciálneho oleja. Proces destilácie vodnou parou je založený na Daltonovom zákone, podľa ktorého sa dve nemiešateľné kvapaliny destilujú pri nižšej teplote, ako každá samostatne, pretože k tvorbe pár takýchto zmesí dochádza vtedy, ak súčet parciálnych tlakov zložiek zmesi a atmosférický tlak je rovnaký.
Na získanie aromatických vôd sa suroviny z esenciálnych olejov umiestnia do destilačnej kocky, cez ktorú prechádza vodná para, pričom silicu unáša do kondenzátora (obr. 53).
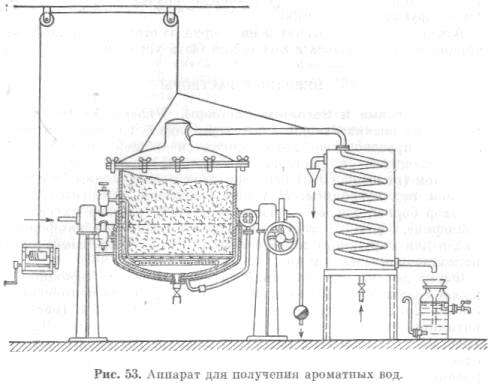
V chladiči chladenom studenou vodou pary vody a silice kondenzujú a odtekajú do prijímača vo forme hotovej aromatickej vody. Ak sa počas destilácie vytvorí nadbytok esenciálneho oleja, ktorý sa nerozpustí vo vode, naleje sa do oddelených nádob.
Z destilovaných aromatických vôd vo farmaceutickej praxi sa viac -menej používa horká mandľová voda (Aqua Amygdalarum amararum) a kôprová voda (Aqua Foeniculi), používané vnútorne na zlepšenie črevných funkcií.
Aromatické vody sa pripravujú aj s alkoholom. V tomto prípade je možné koncentráciu esenciálnych olejov v nich zvýšiť.
13.1. Rozpustnosť látok vo vode
Riešenie je homogénny systém pozostávajúci z dvoch alebo viacerých látok, ktorých obsah je možné v určitých medziach meniť bez narušenia homogenity.
Vodné riešenia pozostávajú z voda(rozpúšťadlo) a rozpustená látka. Stav látok vo vodnom roztoku je v prípade potreby indikovaný dolným indexom (p), napríklad KNO 3 v roztoku - KNO 3 (p).
Často sa nazývajú roztoky, ktoré obsahujú malé množstvo rozpustenej látky zriedený a roztoky s vysokým obsahom rozpustených látok - koncentrovaný. Nazýva sa roztok, v ktorom je možné ďalšie rozpustenie látky nenasýtené a roztok, v ktorom sa látka za daných podmienok prestáva rozpúšťať, je nasýtený. Posledne uvedený roztok je vždy v kontakte (v heterogénnej rovnováhe) s nerozpustnou látkou (jedným alebo viacerými kryštálmi).
Za špeciálnych podmienok, napríklad pri miernom (bez miešania) chladení horúceho nenasýteného roztoku pevný môžu vznikať látky presýtené Riešenie. Keď sa zavedie kryštál látky, takýto roztok sa rozdelí na nasýtený roztok a zrazeninu látky.
V súlade s chemická teória roztokov D.I. Mendeleev, rozpustenie látky vo vode je sprevádzané, po prvé, zničenie chemické väzby medzi molekulami (intermolekulárne väzby v kovalentných látkach) alebo medzi iónmi (v iónových látkach), a teda častice látky sa miešajú s vodou (v ktorej je zničená aj časť vodíkových väzieb medzi molekulami). K lámaniu chemických väzieb dochádza v dôsledku tepelnej energie pohybu molekúl vody, pričom výdavkov energia vo forme tepla.
Za druhé, keď sú vo vode prítomné častice (molekuly alebo ióny) látky hydratácia. Ako výsledok, hydratuje- zlúčeniny neurčitého zloženia medzi časticami hmoty a molekulami vody ( vnútorné zloženie samotné častice sa po rozpustení nemenia). Tento proces sprevádza zvýraznenie energia vo forme tepla v dôsledku tvorby nových chemických väzieb v hydrátoch.
Riešenie je vo všeobecnosti buď chladí(ak spotreba tepla prekročí jeho uvoľnenie), alebo sa zahreje (inak); niekedy - ak sú spotreba tepla a jeho uvoľnenie rovnaké - teplota roztoku zostane nezmenená.
Mnoho hydrátov je tak stabilných, že sa nezničia ani vtedy, keď sa roztok úplne odparí. Sú teda známe pevné kryštalické hydráty solí CuS04 5H20, Na2C03 10H20, KAl (SO4) 2 12H20, atď.
Obsah látky v nasýtenom roztoku pri T= konšt kvantitatívne charakterizuje rozpustnosť tejto látky. Rozpustnosť je typicky vyjadrená hmotnosťou rozpustenej látky na 100 g vody, napríklad 65,2 g KBr / 100 g H20 pri 20 ° C. Ak sa teda 70 g pevného bromidu draselného zavedie do 100 g vody pri 20 ° C, potom do roztoku (ktorý bude nasýtený) prejde 65,2 g soli a 4,8 g pevného KBr (prebytok) zostane dno skla.
Malo by sa pamätať na to, že obsah rozpustenej látky v nasýtený Riešenie rovná sa, v nenasýtené Riešenie menšie a v presýtené Riešenie viac jeho rozpustnosť pri danej teplote. Roztok pripravený pri 20 ° C zo 100 g vody a síranu sodného Na2S04 (rozpustnosť 19,2 g / 100 g H20), s obsahom
15,7 g soli - nenasýtené;
19,2 g soli - nasýtené;
2O. 3 g soli - presýtené.
Rozpustnosť tuhých látok (tabuľka 14) sa spravidla zvyšuje so zvyšujúcou sa teplotou (KBr, NaCl) a iba pri niektorých látkach (CaS04, Li2CO3) je pozorovaný opak.
Rozpustnosť plynov klesá so zvyšujúcou sa teplotou a zvyšuje sa so zvyšujúcim sa tlakom; napríklad pri tlaku 1 atm je rozpustnosť amoniaku 52,6 (20 ° C) a 15,4 g / 100 g H20 (80 ° C) a pri 20 ° C a 9 atm je to 93,5 g / 100 g H 2 O.
V súlade s hodnotami rozpustnosti sa rozlišujú látky:
– dobre rozpustný ktorých hmotnosť v nasýtenom roztoku je porovnateľná s hmotnosťou vody (napríklad KBr - rozpustnosť pri 20 ° C je 65,2 g / 100 g H20; 4,6 M roztok), tvoria nasýtené roztoky s molaritou viac ako 0,1 M;
– mierne rozpustný ktorých hmotnosť v nasýtenom roztoku je oveľa menšia ako hmotnosť vody (napríklad CaS04 - pri 20 ° C je rozpustnosť 0,206 g / 100 g H20; 0,015 M roztok), tvoria nasýtené roztoky s molaritou 0,1-0,001 M;
– prakticky nerozpustný ktorých hmotnosť v nasýtenom roztoku je v porovnaní s hmotnosťou rozpúšťadla zanedbateľná (napríklad AgCl - pri 20 ° C je rozpustnosť 0,00019 g na 100 g H20; 0,0000134M roztok), tvoria nasýtené roztoky s menšou molaritou ako 0,001 mil.
Na základe zostavených referenčných údajov tabuľka rozpustnosti bežné kyseliny, zásady a soli (tabuľka 15), ktorá udáva typ rozpustnosti, označené látky, ktoré nie sú vedecky známe (neboli získané) alebo sú vodou úplne rozložené.
Konvencie použité v tabuľke:
"P" je vysoko rozpustná látka
„M“ - zle rozpustná látka
"N" - prakticky nerozpustná látka
" -" - látka nebola prijatá (neexistuje)
“- látka sa neobmedzene mieša s vodou
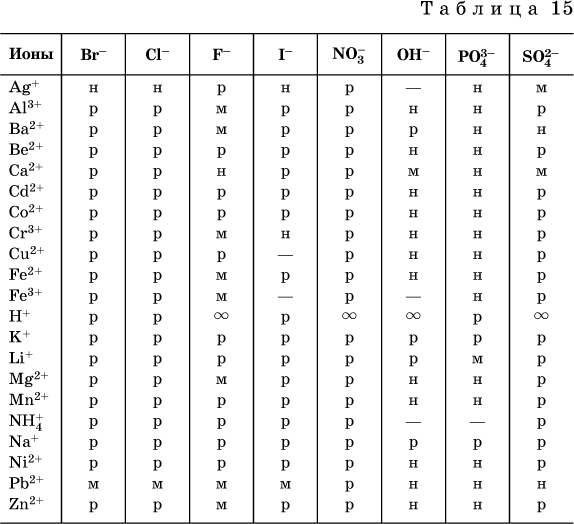
Poznámka. Táto tabuľka zodpovedá príprave nasýteného roztoku pri izbovej teplote zavedením látky (vo vhodnom stave agregácie) do vody. Je potrebné poznamenať, že nie je vždy možné získať zrazeniny zle rozpustných látok pomocou iónomeničových reakcií (podrobnejšie pozri 13.4).




